科學家對幾個世紀前元素的周期表有基本的理解。但是在19世紀後期,俄羅斯化學家DMITRI Mendeleev出版了他第一次根據原子量對化學元件進行分組的嘗試。當時只有大約60個要素,但Mendeleev意識到,當元素通過重量組織時,某些類型的元素會以常規的間隔或週期發生。
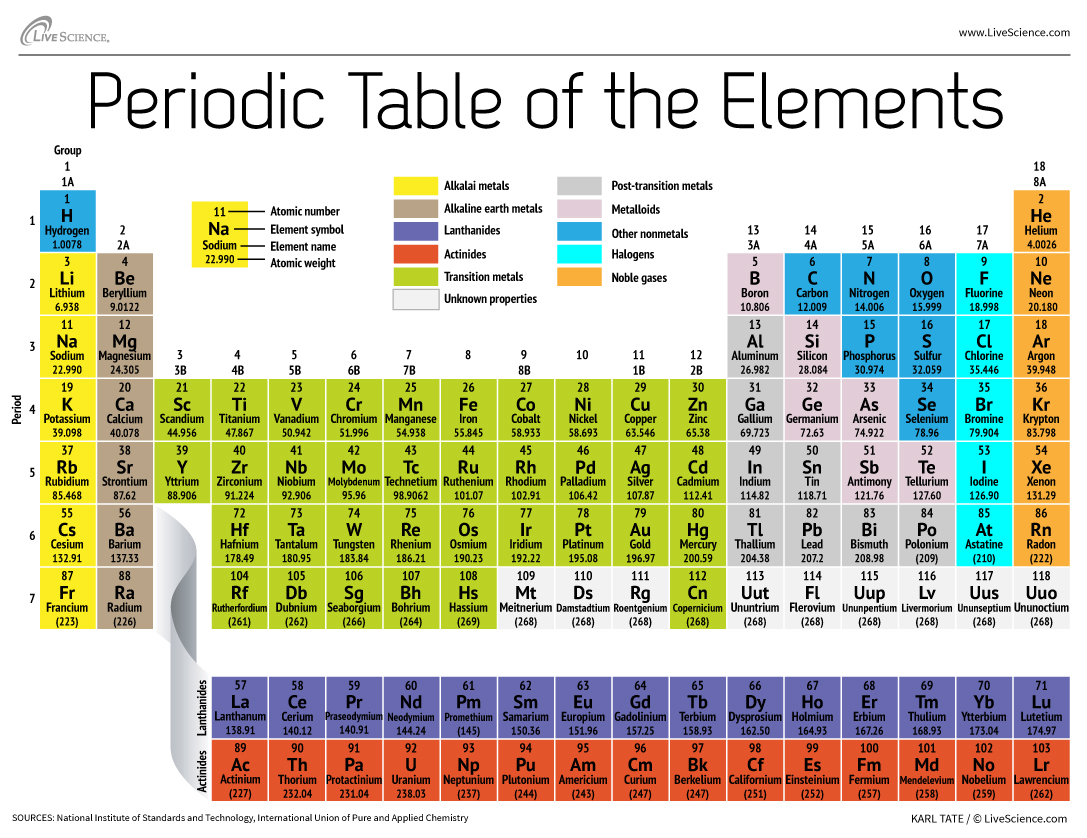
150年後的今天,化學家正式認識了118個要素(在2016年增加了四個新移民之後),但仍在使用Mendeleev的元素週期表組織它們。表從最簡單的原子,氫開始,然後按原子數(即質子的數量)組織其餘元素。除少數例外,元素的順序與每個原子的質量增加相對應。
該桌有7行和18列。每行代表一個時期;一個元素的周期數表示其能量水平有多少個容器電子。鈉,例如,在第三階段坐著,這意味著鈉原子通常在前三個能級中具有電子。向下移動桌子,時間更長,因為它需要更多的電子才能填充更大,更複雜的外部水平。
表的列代表元素的組或家族。小組中的元素通常看起來和行為相似,因為它們在最外殼中具有相同數量的電子 - 他們向世界展示的臉部。例如,在桌子的最右側,第18組元素具有完全完整的外殼,很少參與化學反應。
元素通常被歸類為金屬或非金屬,但兩者之間的劃分線是模糊的。金屬元素通常是電力和熱量的良好導體。金屬中的亞組基於這些集合的相似特徵和化學性質。我們對周期表的描述使用了通常接受的元素分組洛斯阿拉莫斯國家實驗室。
週期表
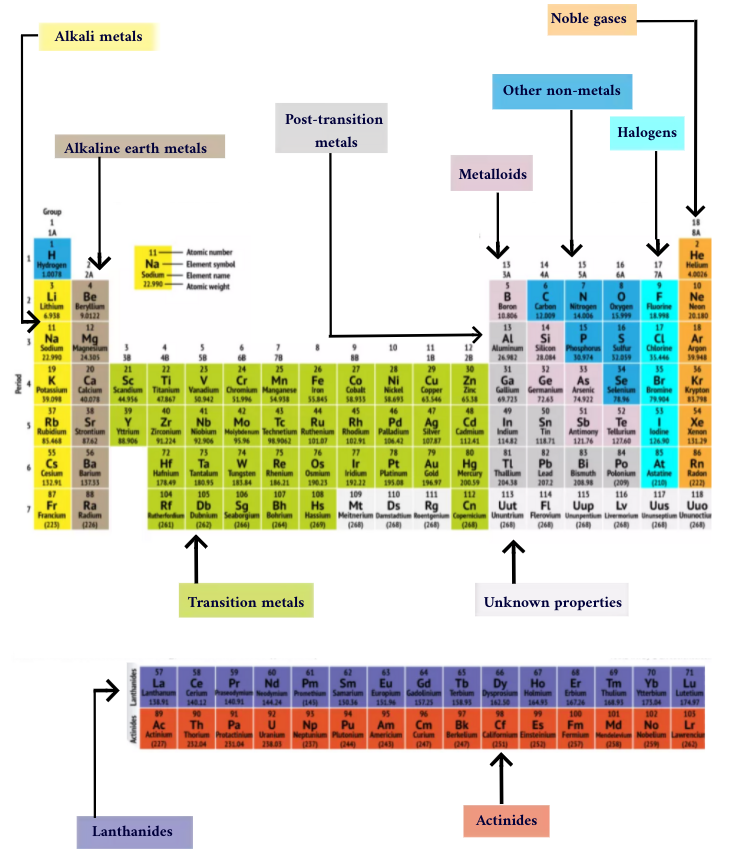
鹼金屬:鹼金屬構成了第1組的大部分,即表的第一列。這些金屬從閃亮而柔軟,足以用刀切割,從鋰(li)並以鍅(fr)。他們也非常反應性,會突然起火甚至在與水接觸時爆炸,因此化學家將它們存放在油或惰性中氣體。氫具有單一電子,也生活在第1組中,但氣體被認為是非金屬的。
鹼土金屬:鹼金屬構成了元素週期表的第2組,鈹(BE)通過鐳(RA)。這些元素中的每一個都有兩個電子在其最外面的能級,這使鹼性地球足夠反應,以至於它們在自然界中很少被發現。但是它們不像鹼金屬那樣活化。與鹼金屬相比,它們的化學反應通常更慢,並且產生的熱量較少。
燈籠:第三組太長了,無法適應第三列,因此它被拆開並側面翻轉,以成為越過桌子底部的島上排行榜。這是燈籠,元素57至71-鑭(la)到鎦(魯)。該組中的元素具有銀色的白色,並且與空氣接觸時會發生污垢。
Actinides:Actinides沿著島的底部排列,包括元素89,陽離子(AC),直到103,勞倫斯(LR)。在這些元素中,只有釷(th)和鈾(u)自然發生在地球上。所有都是放射性的。 actinides和Lanthanides一起形成一個稱為內部過渡金屬的組。
過渡金屬:返回桌子的主體,其餘3到12組代表其餘的過渡金屬。艱難但具有延展性,閃亮且具有良好的導電性,這些元素通常是您聽到金屬詞時通常會想到的。金屬世界中許多最偉大的熱門歌曲 - 包括金子,,,,銀,,,,鐵和鉑- 住在這裡。
過渡後金屬:在進入非金屬世界之前,共享特徵並沒有沿垂直組線條整齊。過渡後金屬是鋁(al),,鎵(ga),,銦(在),鉈(TL),錫(SN),帶領(pb)和鉍(BI),它們將第13組跨入第17組。這些元素具有過渡金屬的一些經典特徵,但是它們比其他過渡金屬傾向於柔軟,並且效果更差。許多周期桌將在對角線連接硼與Astatine的下方具有大膽的“樓梯”線。過渡後金屬群集到該線的左下角。
金屬體:金屬是硼(b),,矽(和),鍺(GE),,砷(作為),銻(SB),碲(TE)和釙(po)。它們形成了代表從金屬到非金屬的逐漸過渡的樓梯。這些元素有時以半導體(B,SI,GE)而不是導體來表現。金屬也稱為“半法”或“可憐的金屬”。
非金屬:樓梯右上方的所有其他東西 - 加上氫(h),滯留在第1組中 - 是一種非金屬。這些包括碳(c),,氮(n),,磷(p),氧(o),硫(沙硒(SE)。
鹵素:第17組的前四個要素,來自氟(f)通過砈(at),代表非金屬的兩個子集之一。鹵素是化學反應性並傾向於與鹼金屬配對以生產各種類型的鹽。例如,廚房中的餐鹽是鹼金屬鈉和鹵素氯之間的婚姻。
貴重氣:無色,無味且幾乎完全沒有反應性,惰性或貴重氣體在第18組中圍繞桌子。許多化學家都期望oganesson(以前指定為“解污劑”),是共享這些特徵的四個新命名元素之一;但是,由於此元素在毫秒中具有半衰期的測量,因此沒有人能夠直接對其進行測試。Oganesson完成了期刊表的第七階段,因此,如果有人設法合成元素119(和元素119)這樣做的競賽已經在進行),它將在鹼金屬柱中旋轉以開始第8行。
由於賦予表格名稱的周期性創造的周期性性質,有些化學家更喜歡可視化Mendeleev的桌子作為圈子。
週期表測驗
其他資源:
- 觀看此簡短的視頻,內容涉及元素週期表和元素組,速成課程。
- 翻閱這個互動週期表的元素表ptable.com。
- 查看此免費的在線教育資源,以了解CK-12。