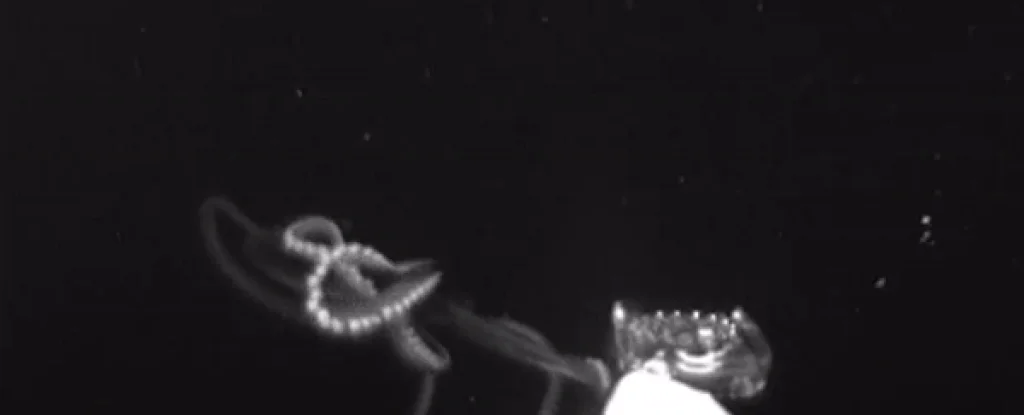
研究人员发现了一种名为 Aplp1 的细胞表面蛋白如何在传播负责的材料中发挥作用。大脑中从细胞到细胞的疾病。
有望获得 FDA 批准靶向另一种蛋白质的药物滞后3– 与相互作用应用程序1– 阻止小鼠体内的传播,表明潜在的治疗方法可能已经存在。
在一个最近的论文,一个国际科学家团队描述了这两种蛋白质如何共同作用来帮助有害的α-突触核蛋白蛋白质团块进入脑细胞。
约翰·霍普金斯大学的神经科学家毛晓波表示:“既然我们知道了 Aplp1 和 Lag3 是如何相互作用的,我们就有了一种新的方式来理解 α-突触核蛋白如何促进帕金森病的疾病进展。”说六月。
“我们的研究结果还表明,针对这种与药物的相互作用可以显着减缓帕金森病和其他神经退行性疾病的进展。”
超过850万人全球范围内都有帕金森病第二常见的神经退行性疾病后。
作为一种进行性运动障碍,通常只有在出现症状时才会被诊断出来,这些症状包括颤抖、僵硬、平衡问题、言语困难、睡眠模式紊乱和心理健康问题。目前这种疾病无法治愈,意味着患者最终可能会难以行走或说话。
帕金森病的症状主要是由于大脑中产生多巴胺的神经元死亡或受损造成的。黑色物质,一个涉及精细运动控制的区域。这被认为是由路易体,它们是异常的蛋白质团块,主要由在神经元之间传播的错误折叠的α-突触核蛋白组成。
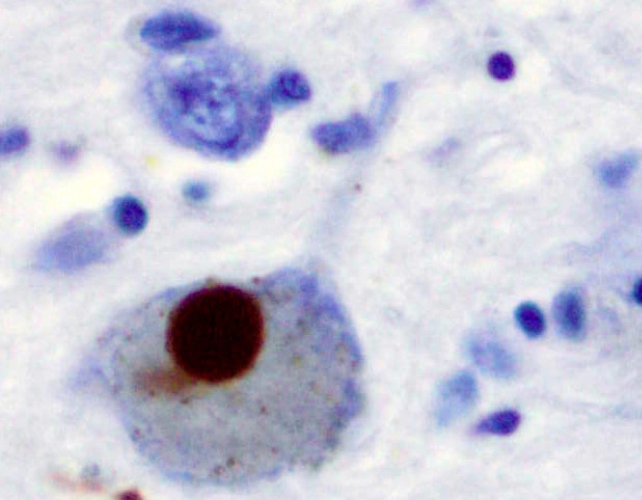
α-突触核蛋白通常维持神经元之间的功能通讯,但当它错误折叠和不溶解时就会出现问题。也就是说,确定这是否是是困难的。
过去的学习在老鼠身上发现 Lag3 与 α-突触核蛋白结合并在神经元中传播帕金森病病理学。虽然删除 Lag3 会显着阻碍这一过程,但它并不能完全阻止它,这表明另一种蛋白质也与接受错误折叠的 α-突触核蛋白的神经元有关。
“我们之前的工作证明 Lag3 并不是唯一帮助神经元吸收 α-突触核蛋白的细胞表面蛋白,因此我们在最近的实验中转向了 Aplp1,”说约翰·霍普金斯大学神经科学家瓦琳娜·道森。
科学家们对缺失 Aplp1 或 Lag3 或两者都缺失的转基因小鼠进行了测试。他们发现 Aplp1 和 Lag3 可以各自独立地帮助脑细胞吸收有害的 α-突触核蛋白,但它们一起显着增加吸收。
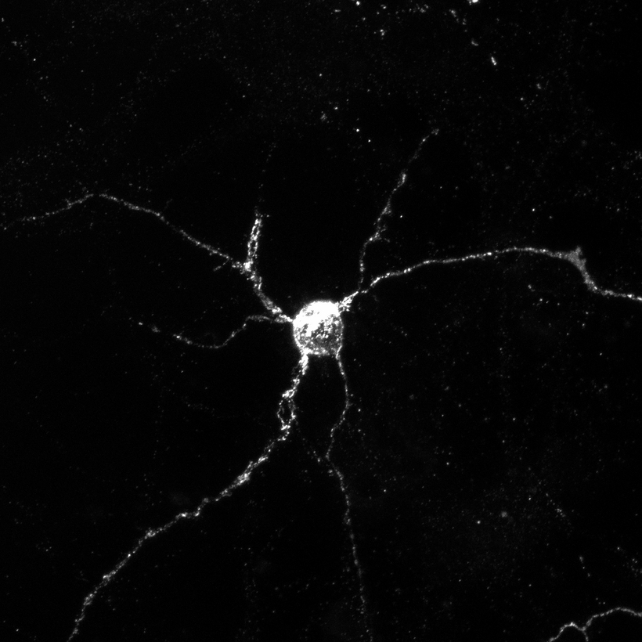
当小鼠同时缺失 Aplp1 和 Lag3 时,进入健康脑细胞的有害 α-突触核蛋白会减少 90%,这意味着与仅缺失一种蛋白相比,缺失这两种蛋白会阻断更多有害蛋白团块。
研究人员给正常小鼠服用这种药物纳武单抗/瑞拉利单抗,一种含有 Lag3 的黑色素瘤药物,并发现它还阻止了 Aplp1 和 Lag3 的相互作用,再次几乎完全阻止了神经元中致病的 α-突触核蛋白团块的形成。
“抗 Lag3 抗体成功地阻止了 α-突触核蛋白种子在小鼠模型中的进一步扩散,并且由于 Aplp1 与 Lag3 密切相关,因此表现出比 Lag3 耗尽更好的功效,”说泰德·道森 (Ted Dawson),约翰·霍普金斯大学神经科学家。
下一步将在帕金森病和阿尔茨海默病小鼠模型上测试 Lag3 抗体 - 其中研究指出Lag3也作为目标。
该研究发表于自然通讯。
本文的早期版本于 2024 年 6 月发布。