这跨膜蛋白206缩写为 TMEM206 是一种进化保守的氯离子通道,是普遍表达、质子激活、向外整流的阴离子电流在一份新报告中,现已发布科学进步邓增勤和美国圣路易斯华盛顿大学医学院的一个多学科研究小组描述了河豚 TMEM206 的低温电子显微镜 (cryo-EM) 结构。该结构形成了一个三聚体通道,具有两个跨膜片段和一个大的细胞外结构域。根据研究结果,邓等人展示了如何从三个侧门横向进入细胞外区域的宽敞前庭,其中中央孔包含多个结构。例如,靠近内螺旋胞质区域的保守赖氨酸残基可能形成了氯离子选择性过滤器。核心结构和组装类似于氨基酸序列无关的钠通道,因此传导阳离子而不是阴离子。结合电生理学,他们为一种新型氯通道的离子传导和门控提供了见解,这种通道在结构上与之前描述的氯通道家族不同。
氯离子通道
氯离子是动物体内含量丰富的阴离子,它们通过以下方式跨细胞膜移动氯离子通道和转运体参与多种细胞功能,包括细胞体积调节、细胞内酸化和肌肉的兴奋性控制. 这些离子在哺乳动物细胞中被广泛观察到,尽管其背后的分子成分潮流有仍然难以捉摸到目前为止。两项使用全基因组 RNA 干扰筛选的独立研究已将 TMEM206 鉴定为潜在的阴离子通道TMEM206 在脊椎动物中进化保守。氯离子通道在氨基酸序列和三维结构上都存在差异。在这项研究中,邓等人提出了一种(低温电子显微镜)河豚 TMEM206 的结构,揭示了与之前已知的不同的三聚体通道结构。科学家们结合电生理学通过这项工作首次对进化上保守且广泛表达的氯离子通道的结构和功能进行描述,从而建立分子框架并了解氯离子传导和通道门控。
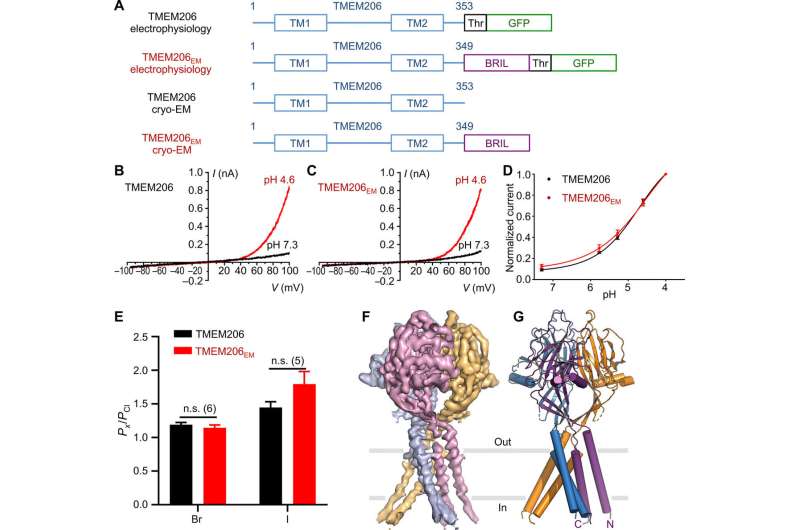
融合策略来确定低温电子显微镜结构。
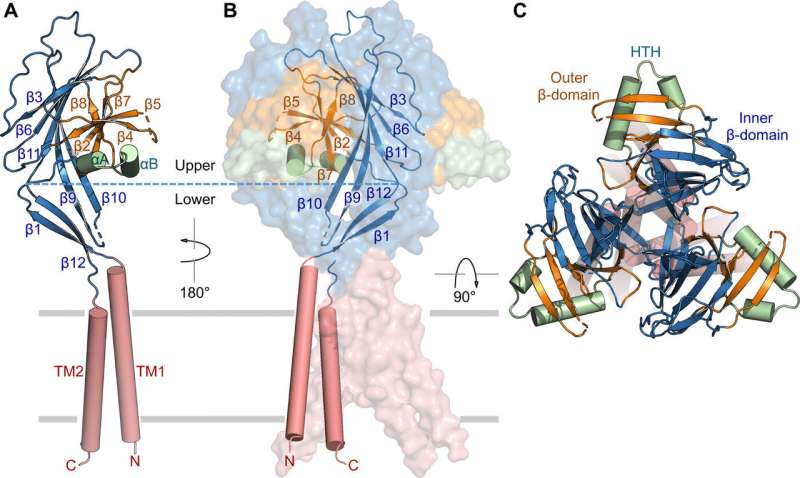
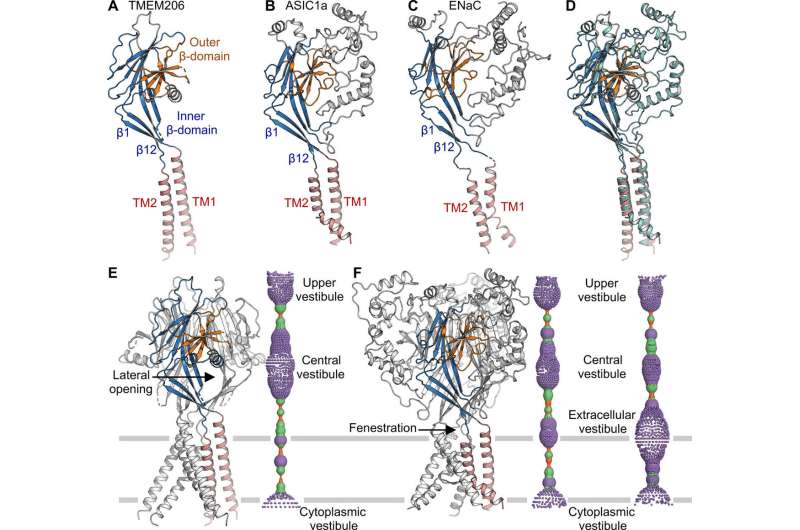
研究人员使用绿色荧光蛋白标记的构建体来识别 TMEM206 候选物,并选定河豚 TMEM206,因为它们与人类有 50% 的序列同一性邓等人随后纯化了全长野生型河豚 TMEM206 蛋白,并对其进行了单颗粒低温电子显微镜分析。他们利用 3D 重建图揭示了具有跨膜和膜外结构域的三聚体通道结构。TMEM206 形成对称三聚体,其中每个亚基包含一个跨膜区(TMD)具有两个跨膜螺旋,分别称为 TM1 和 TM2,以及一个富含 ?-结构域的大细胞外结构域(ECD),其中额外的基序进一步组织在上层和下层。此外,广泛的侧链接触涉及通过范德华相互作用在内部和外部-? 结构域中。三聚体通道组装在细胞外区域中间引入了三个侧开口或侧门,可能有助于离子和水的通过。细长的侧门延伸到 ECD-TMD 连接处,以恢复紧密的堆积相互作用。为了克服确定蛋白质结构的任何技术困难,邓等人将 C 端融合骨限制性干扰素诱导跨膜样蛋白(缩写为 BRIL);一种四螺旋束蛋白,广泛用作结晶伴侣,以改善膜稳定性并促进晶体形成。
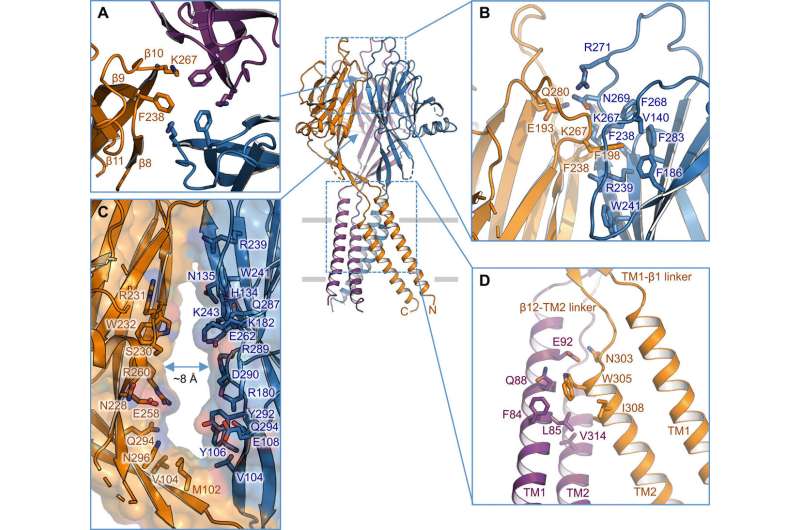
离子渗透途径和诱变研究
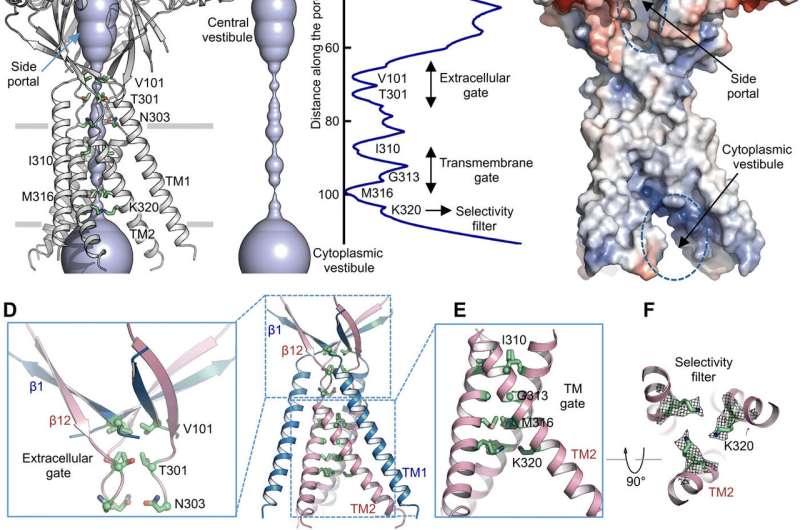
使用孔隙半径计算,Deng 等人展示了中央离子传导孔如何包含多个收缩以阻止离子通过。由于用于确定低温电子显微镜结构的高 pH 缓冲条件(pH 8.0),该结构代表非导电构象。由于胞外域缺乏蛋白质 - 蛋白质接触,因此可以从侧面进入体积大且细长的中央前庭。蛋白质通道的狭窄点不会干扰离子传导,并且可以在通道门控周期中保持,因为离子会通过三个侧门。中央前庭和侧入口内壁的微正电势也促进了氯离子的吸引。在胞外域-跨膜域 (ECD-TMD) 连接处,三条链连接到外螺旋并向内移动以加入内螺旋,从而在双脂层上方产生胞外门。面向孔的位置的连续结构形成疏水门,可以阻止离子传导。
为了支持结构性发现,Deng 等人进行了诱变研究关键的孔内残基。当他们用丙氨酸或酸性残基,酸激活氯离子电流消失。相反,精氨酸替代保留了通道功能,进一步支持了阴离子选择性过滤器中对正电荷的要求。例如,I310 结构域构成了跨膜门的关键组成部分,而另一个称为 K320 的结构则构成了阴离子选择性过滤器。该研究支持了人类和河豚直系同源物之间的结构保守性,从而代表了氯离子通道的生理相关模型。
结构融合
TMEM206 的拓扑结构和组装与上皮钠通道 (ENaC)/退化蛋白超家族离子通道,包括酸敏感离子通道(ASIC);尽管缺乏不同的氨基酸序列同源性两个通道之间。带相反电荷的钠离子和氯离子的三聚体通道,尽管如此,共享一个共同的核心结构,两侧有两个跨膜螺旋。研究小组注意到,在通道激活后,中央前庭和跨膜孔之间的细胞外门如何扩张,使离子通过。而上皮细胞可以通过胞外域的蛋白水解释放抑制肽来激活,而 ASIC 和 TMEM206 只能由细胞外质子激活. TMEM 和 AS1CS 之间保守的结构特征也表明这两个分子具有类似的门控构象变化。
外表
这样,邓增勤及其同事利用单粒子低温电子显微镜确定了传统X射线晶体学通常无法获得的整合膜蛋白的结构。由于对比度和信噪比较低,对于小尺寸的膜蛋白,实现近原子分辨率仍然是一项重大技术挑战。邓等人获得了 3.5 埃分辨率的通过融合小的结晶分子伴侣 BRIL 来改善原本不理想的膜的稳定性蛋白质促进晶体堆积.基于保守的核心结构,这些通道对阳离子或阴离子具有选择性,并经历类似的门控构象变化。该研究建立了一类新的氯离子通道,为细胞和结构生物学的进一步功能和机械研究形成了新的框架。
© 2021 科学X网络
引用: 质子激活氯离子通道TMEM206的低温电子显微结构 (2021年3月18日) 于2024年5月26日检索自 https://webbedxp.com/zh-CN/science/jamaal/news/2021-03-cryo-electron-microscopic-proton-activated-chloride-channel.html
本文件受版权保护。除出于私人学习或研究目的的合理使用外,未经书面许可不得复制任何部分。内容仅供参考。









