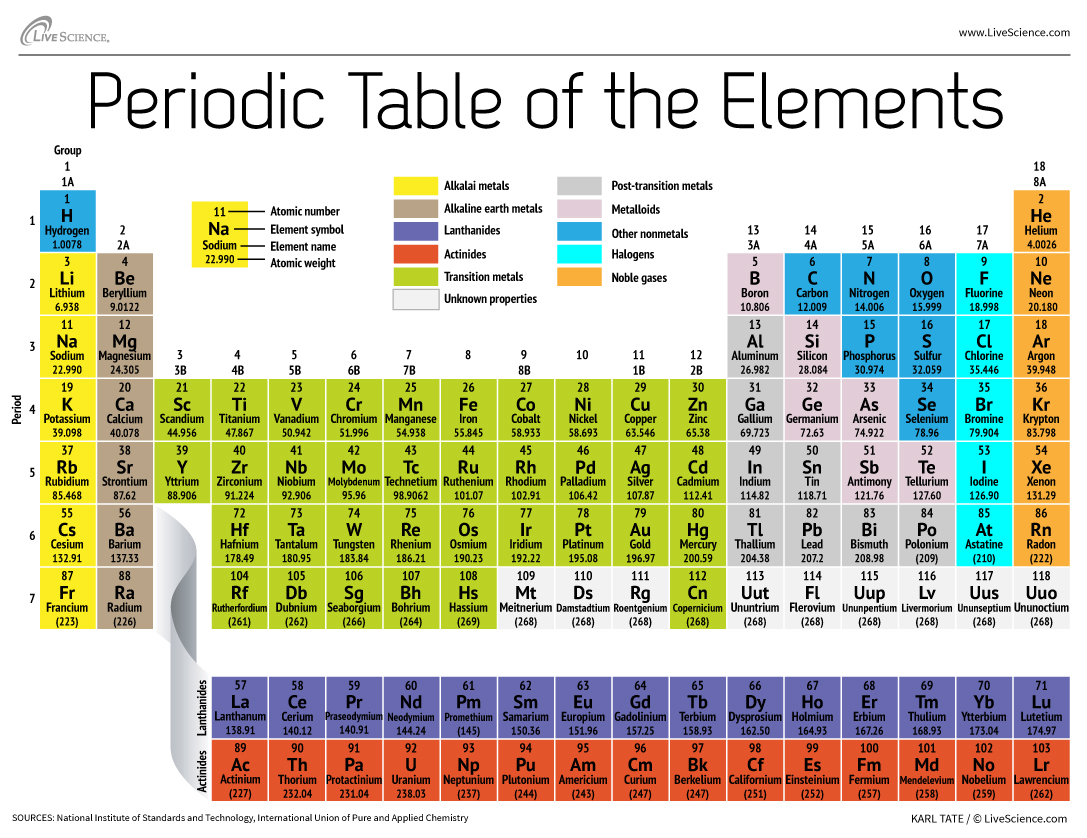
科学家对几个世纪前元素的周期表有基本的理解。但是在19世纪后期,俄罗斯化学家DMITRI Mendeleev出版了他第一次根据原子量对化学元件进行分组的尝试。当时只有大约60个要素,但Mendeleev意识到,当元素通过重量组织时,某些类型的元素会以常规的间隔或周期发生。
150年后的今天,化学家正式认识了118个要素(在2016年增加了四个新移民之后),但仍在使用Mendeleev的元素周期表组织它们。表从最简单的原子,氢开始,然后按原子数(即质子的数量)组织其余元素。除少数例外,元素的顺序与每个原子的质量增加相对应。
该桌有7行和18列。每行代表一个时期;一个元素的周期数表示其能量水平有多少个容器电子。钠,例如,在第三阶段坐着,这意味着钠原子通常在前三个能级中具有电子。向下移动桌子,时间更长,因为它需要更多的电子才能填充更大,更复杂的外部水平。
表的列代表元素的组或家族。小组中的元素通常看起来和行为相似,因为它们在最外壳中具有相同数量的电子 - 他们向世界展示的脸部。例如,在桌子的最右侧,第18组元素具有完全完整的外壳,很少参与化学反应。
元素通常被归类为金属或非金属,但两者之间的划分线是模糊的。金属元素通常是电力和热量的良好导体。金属中的亚组基于这些集合的相似特征和化学性质。我们对周期表的描述使用了通常接受的元素分组洛斯阿拉莫斯国家实验室。
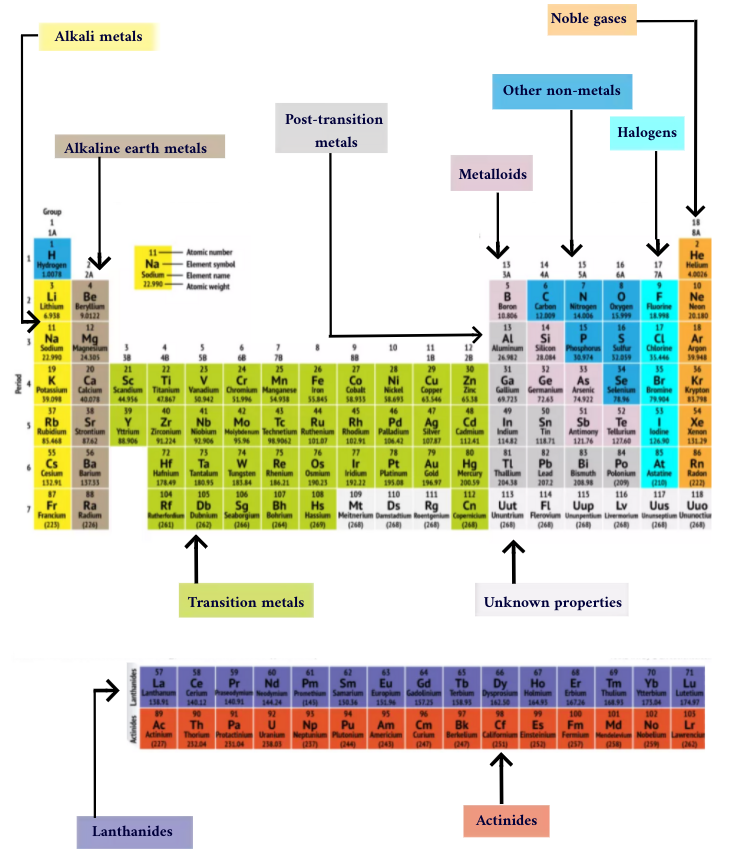
周期表
碱金属:碱金属构成了第1组的大部分,即表的第一列。这些金属从闪亮而柔软,足以用刀切割,从锂(li)并以钫(fr)。他们也非常反应性,会突然起火甚至在与水接触时爆炸,因此化学家将它们存放在油或惰性中气体。氢具有单一电子,也生活在第1组中,但气体被认为是非金属的。
碱土金属:碱金属构成了元素周期表的第2组,铍(BE)通过镭(RA)。这些元素中的每一个都有两个电子在其最外面的能级,这使碱性地球足够反应,以至于它们在自然界中很少被发现。但是它们不像碱金属那样活化。与碱金属相比,它们的化学反应通常更慢,并且产生的热量较少。
灯笼:第三组太长了,无法适应第三列,因此它被拆开并侧面翻转,以成为越过桌子底部的岛上排行榜。这是灯笼,元素57至71-镧(la)到镏(鲁)。该组中的元素具有银色的白色,并且与空气接触时会发生污垢。
Actinides:Actinides沿着岛的底部排列,包括元素89,阳离子(AC),直到103,劳伦斯(LR)。在这些元素中,只有钍(th)和铀(u)自然发生在地球上。所有都是放射性的。 actinides和Lanthanides一起形成一个称为内部过渡金属的组。
过渡金属:返回桌子的主体,其余3到12组代表其余的过渡金属。艰难但具有延展性,闪亮且具有良好的导电性,这些元素通常是您听到金属词时通常会想到的。金属世界中许多最伟大的热门歌曲 - 包括金子,,,,银,,,,铁和铂- 住在这里。
过渡后金属:在进入非金属世界之前,共享特征并没有沿垂直组线条整齐。过渡后金属是铝(al),,镓(ga),,铟(在),铊(TL),锡(SN),带领(pb)和铋(BI),它们将第13组跨入第17组。这些元素具有过渡金属的一些经典特征,但是它们比其他过渡金属倾向于柔软,并且效果更差。许多周期桌将在对角线连接硼与Astatine的下方具有大胆的“楼梯”线。过渡后金属群集到该线的左下角。
金属体:金属是硼(b),,硅(和),锗(GE),,砷(作为),锑(SB),碲(TE)和钋(po)。它们形成了代表从金属到非金属的逐渐过渡的楼梯。这些元素有时以半导体(B,SI,GE)而不是导体来表现。金属也称为“半法”或“可怜的金属”。
非金属:楼梯右上方的所有其他东西 - 加上氢(h),滞留在第1组中 - 是一种非金属。这些包括碳(c),,氮(n),,磷(p),氧(o),硫(沙硒(SE)。
卤素:第17组的前四个要素,来自氟(f)通过砹(at),代表非金属的两个子集之一。卤素是化学反应性并倾向于与碱金属配对以生产各种类型的盐。例如,厨房中的餐盐是碱金属钠和卤素氯之间的婚姻。
贵重气:无色,无味且几乎完全没有反应性,惰性或贵重气体在第18组中围绕桌子。许多化学家都期望oganesson(以前指定为“解污剂”),是共享这些特征的四个新命名元素之一;但是,由于此元素在毫秒中具有半衰期的测量,因此没有人能够直接对其进行测试。Oganesson完成了期刊表的第七阶段,因此,如果有人设法合成元素119(和元素119)这样做的竞赛已经在进行),它将在碱金属柱中旋转以开始第8行。
由于赋予表格名称的周期性创造的周期性性质,有些化学家更喜欢可视化Mendeleev的桌子作为圈子。
周期表测验
其他资源:
- 观看此简短的视频,内容涉及元素周期表和元素组,速成课程。
- 翻阅这个互动周期表的元素表ptable.com。
- 查看此免费的在线教育资源,以了解CK-12。