科學家發現與阿茲海默症相關的「超級傳播者」蛋白質
 可疑蛋白質團塊(紅色)聚集在腦細胞上的插圖。 (但)
可疑蛋白質團塊(紅色)聚集在腦細胞上的插圖。 (但)
一項新的研究利用強大的成像技術揭示了與阿茲海默症相關的蛋白質的子集,其傳播速度特別快。這些「超級傳播者」可能有助於解釋為什麼隨著衰弱性疾病的進展,天然存在的澱粉樣β蛋白的異常團塊會增加。
「這項工作使我們更進一步了解這些蛋白質如何在大腦組織中傳播疾病,"解釋來自瑞士聯邦材料科學與技術實驗室 (EMPA) 的分子物理學家 Peter Nirmalraj。
迄今為止,從我們大腦中混亂的分子纏結中探尋阿茲海默症神經損傷的直接原因已被證明是極其困難的。 β 澱粉樣蛋白斑塊是疾病的原因還是症狀。
實驗室研究發現,針對這些蛋白質的治療已未證明有效。
研究顯示雖然斑塊本身可能不會直接導致神經元損傷,但與斑塊糾纏在一起的其他分子可能是造成損傷的原因。無論如何,了解β澱粉樣蛋白過度生長背後的機制仍可能帶來更好的治療方法。
在他們的新研究中,愛爾蘭利默里克大學的 Nirmalraj 和同事使用強大的新技術來觀察澱粉樣β蛋白如何結合成長鏈原纖維,最終形成纏結的團塊。

研究團隊在鹽溶液中觀察到了這種活動,他們指出,與其他實驗室成像條件相比,鹽溶液更接近我們大腦中的自然環境。
「傳統方法,例如基於染色技術的方法,可能會改變蛋白質的形態和吸附位點,從而無法以天然形式對其進行分析,」Nirmalraj指出。
約250小時的觀察原子力顯微鏡讓研究人員能夠發現一些不尋常的東西。
β 澱粉樣蛋白的特殊風味折疊方式使其邊緣具有額外的反應性,如上圖的明亮區域所示。這意味著他們更容易累積自己的額外建置模組?它們的線狀原纖維比其他類型的β澱粉樣蛋白更快地穿過大腦。
「一小群表現出較高表面催化活性的原纖維被鑑定為超級傳播者,」該團隊在他們的論文中寫道。
這些超級傳播者β-澱粉樣蛋白42僅在初始β-澱粉樣蛋白原纖維形成後形成二級結構(見下圖)。
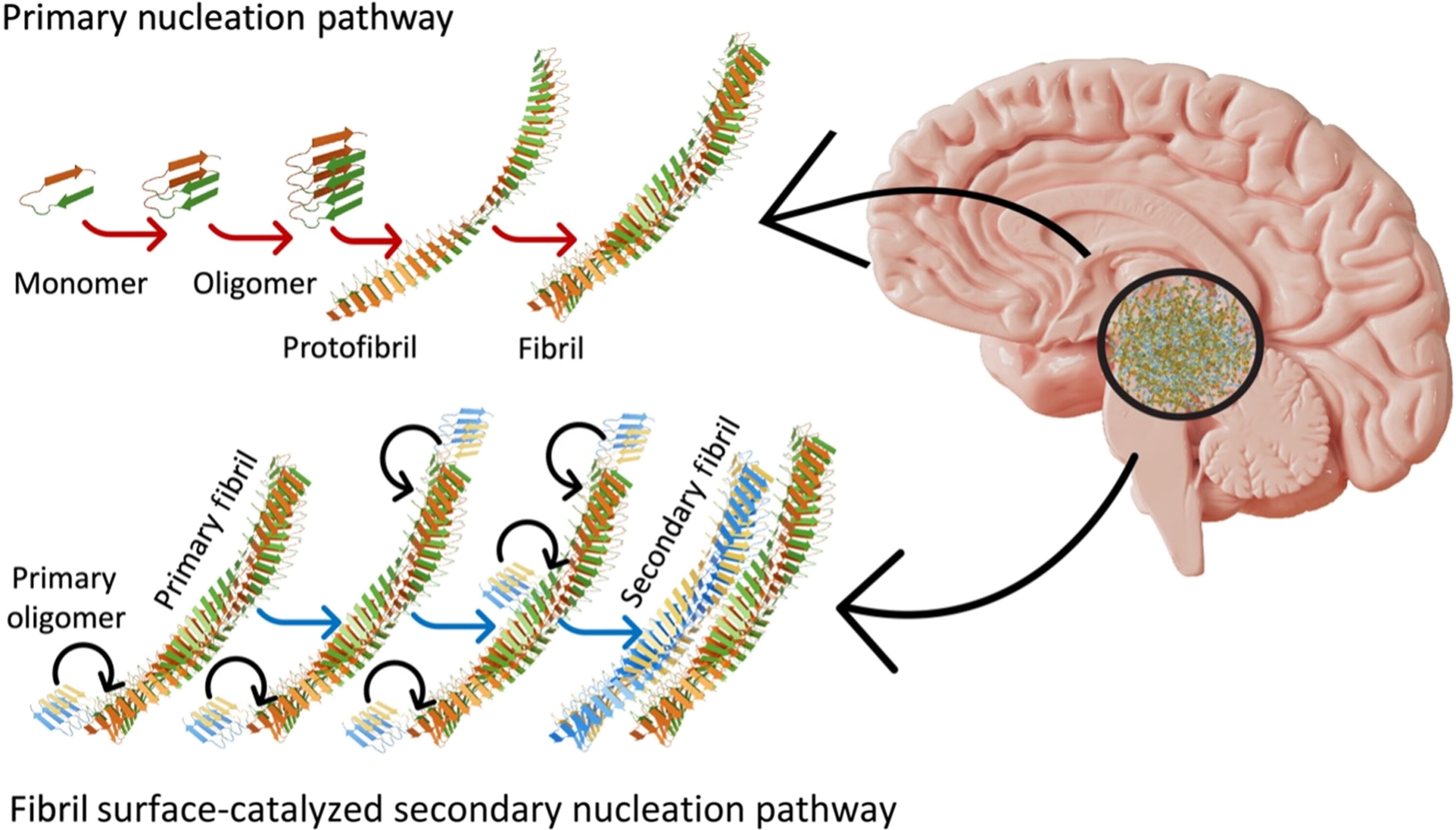
Nirmalraj 和團隊闡明了這些蛋白質團塊的形狀和大小,但其結構的細節尚未解決。這些細節包括 β 澱粉樣蛋白 42 在化學上是否與其他 β 澱粉樣蛋白有差異以及如何差異,以及什麼化學作用驅動這些二級結構的生長。
先前的研究發現作為β澱粉樣蛋白聚集在大腦中,人們患有越來越令人痛苦的症狀例如記憶力減退、衝動行為、焦慮和混亂。這仍然只是一種關聯,癡呆症腦損傷的直接機制尚不清楚。
幾十年來發生了巨大複雜的變化 患有神經退化性疾病的人。所以還有其他理論也需要繼續探索,像是阿茲海默症。
這項研究發表於科學進步。