缩写词已成为同义词,占据中心舞台作为识别遗传密码的一种手段,然后具有不可思议的精确度。
在其作为细菌免疫手段的最初功能中,(成簇规则间隔短回文重复序列/CRISPR相关核酸内切酶)系统寻找已知的入侵基因并使它们功能失调。
来自美国罗切斯特大学和康奈尔大学伊萨卡分校的科学家们发现这种著名的基因编辑工具在细菌中的作用不仅仅是发现 DNA 并进行切割; 它还与其他蛋白质协调,增强对入侵病毒的防御能力。
激活漏斗状蛋白质? 称为 Csx28 ? 扰乱细菌细胞膜的渗透性,使入侵的病毒 DNA 难以劫持细胞机器并进行复制。
该发现发表于科学,是“出乎意料的,并提出了各种新问题,”说罗彻斯特大学生物化学家马克·杜蒙特是这项研究的合作者。
“虽然没有直接的医学相关性或应用,但由此产生的想法可能非常强大,”杜蒙特说。
该研究涉及一系列实验,其中大肠杆菌细菌被感染了感染细菌或噬菌体,称为肠杆菌噬菌体?。
这种噬菌体像登月舱一样附着在细菌细胞表面,并将其 DNA 注入细胞中以创建自身的副本。
这大肠杆菌回击,使用 CRISPR 来通过匹配重复的 DNA 片段来识别威胁 以前遇到过噬菌体,然后使用一种名为 Cas13b 的酶将入侵的 DNA 剪成碎片。
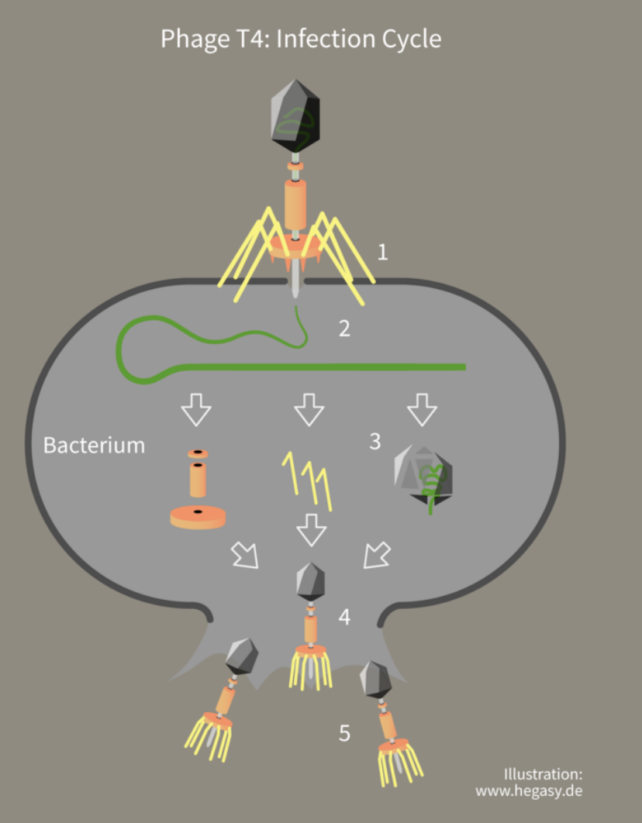
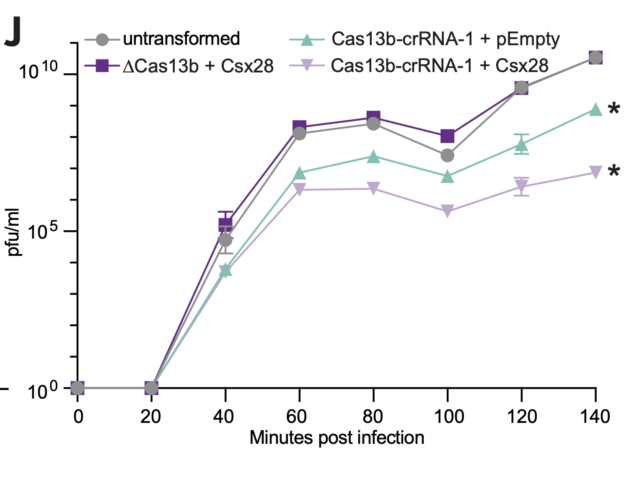
研究人员发现,当 Csx28 存在于细菌内部时,病毒复制缓慢。
这种蛋白质只能与 Cas13b 结合使用,这表明两者正在相互协调来解除病毒的武装。
当 Cas13b 和 Csx28 都存在时,释放感染性病毒颗粒的受感染细菌的比例从大约 19% 下降到大约 3%,并且每毫升噬菌体数量显着减少。 换句话说,病毒无法像平常那样复制。
- 研究人员使用一种名为“Csx28”的技术检查了 Csx28 蛋白的结构。低温电子显微镜发现它像一个漏斗,中间有一个洞。
这提出了一种可能性,即该蛋白质形成膜孔并扰乱细胞的新陈代谢,使其成为病毒不适宜生存的环境。
研究人员使用一种技术测试了这一假设,该技术可以使细胞在失去活性后发出荧光。膜电位,由于细胞内外离子浓度差异而产生的小电荷。
他们发现这两种蛋白质一起导致细胞膜去极化,释放出大量带电原子,从根本上改变了细胞的内部环境。 90 分钟后,40% 的细菌群体以这种方式去极化。
“当你读到这篇论文时,你会想:‘什么?’ 这是一个非常奇怪的机制,”说罗切斯特大学分子生物学家约翰·卢克(John Lueck)没有参与这项研究。
“令人印象深刻的是,该团队发现了这种孔状蛋白质,它与我们以前见过的任何其他蛋白质都不一样,”他说。 “这很令人兴奋,因为在科学中,当你触及表面时,你常常会发现背后有一个全新的世界。”
这篇论文发表于科学。