一项新的研究利用强大的成像技术揭示了与阿尔茨海默病相关的蛋白质的一个子集,其传播速度特别快。这些“超级传播者”可能有助于解释为什么随着衰弱性疾病的进展,天然存在的淀粉样β蛋白的异常团块会增加。
“这项工作使我们更进一步了解这些蛋白质如何在大脑组织中传播疾病,”解释来自瑞士联邦材料科学与技术实验室 (EMPA) 的分子物理学家 Peter Nirmalraj。
迄今为止,从我们大脑中混乱的分子缠结中探寻阿尔茨海默氏症神经损伤的直接原因已被证明是极其困难的。 β 淀粉样蛋白斑块是疾病的原因还是症状。
实验室研究发现,针对这些蛋白质的治疗已未证明有效。
研究表明虽然斑块本身可能不会直接导致神经元损伤,但与斑块纠缠在一起的其他分子可能是造成损伤的原因。无论如何,了解β淀粉样蛋白过度生长背后的机制仍可能带来更好的治疗方法。
在他们的新研究中,爱尔兰利默里克大学的 Nirmalraj 和同事使用强大的新技术来观察淀粉样β蛋白如何结合成长链原纤维,最终形成缠结的团块。

研究小组在盐溶液中观察到了这种活动,他们指出,与其他实验室成像条件相比,盐溶液更接近我们大脑中的自然环境。
“传统方法,例如基于染色技术的方法,可能会改变蛋白质的形态和吸附位点,从而无法以天然形式对其进行分析,”Nirmalraj指出。
约250小时的观察原子力显微镜让研究人员能够发现一些不寻常的东西。
β 淀粉样蛋白的特殊风味折叠方式使其边缘具有额外的反应性,如上图的明亮区域所示。这意味着它们更容易积累额外的自身构建模块——比其他类型的β淀粉样蛋白更快地将线状原纤维延伸到大脑中。
“一小群表现出较高表面催化活性的原纤维被鉴定为超级传播者,”该团队在他们的论文中写道。
这些超级传播者β-淀粉样蛋白42仅在初始β-淀粉样蛋白原纤维形成后形成二级结构(见下图)。
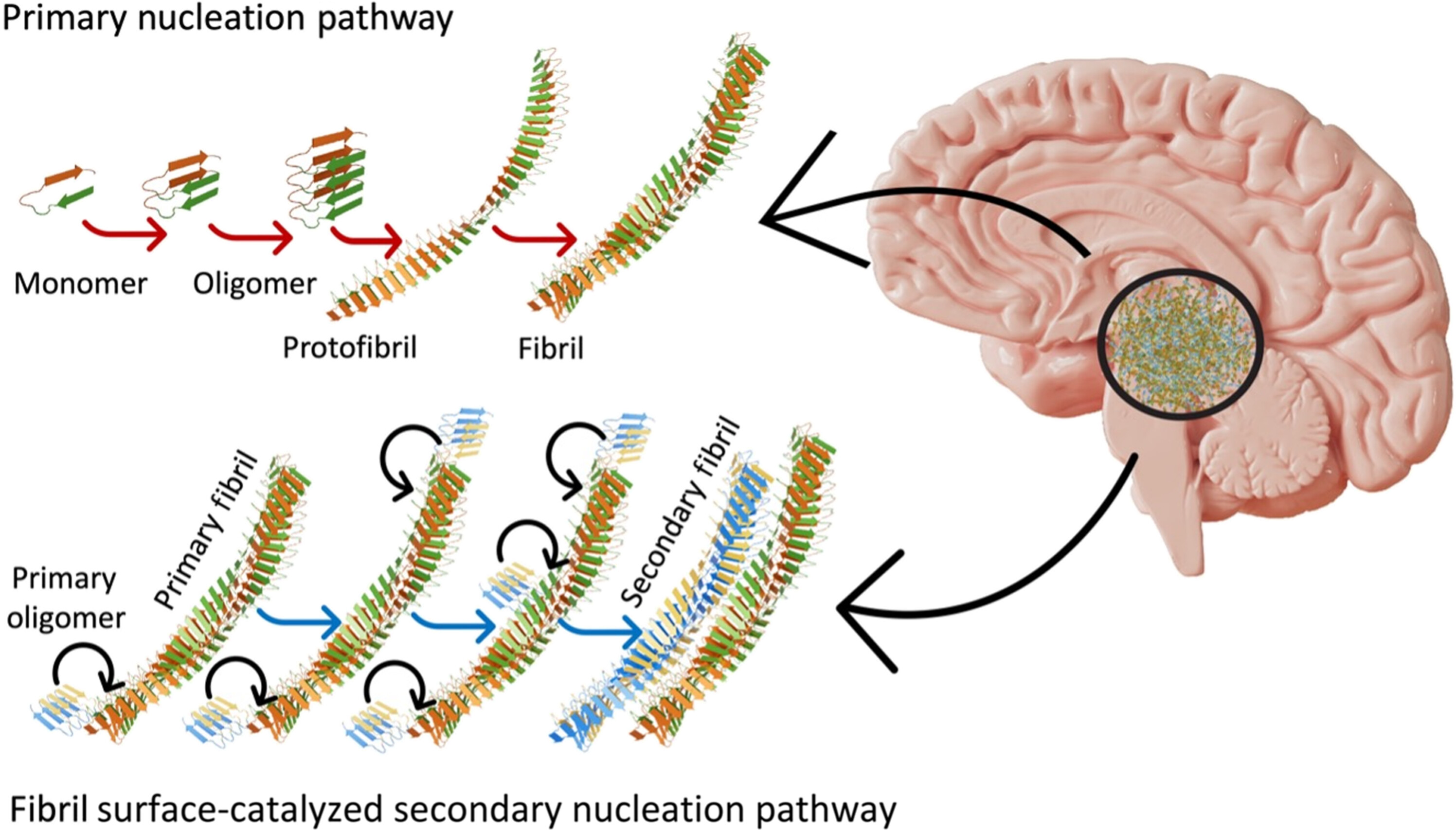
Nirmalraj 和团队阐明了这些蛋白质团块的形状和大小,但其结构的细节尚未解决。这些细节包括 β 淀粉样蛋白 42 在化学上是否与其他 β 淀粉样蛋白有差异以及如何差异,以及什么化学作用驱动这些二级结构的生长。
先前的研究发现作为β淀粉样蛋白聚集在大脑中,人们患有越来越令人痛苦的症状例如记忆力减退、冲动行为、焦虑和混乱。这仍然只是一种关联,痴呆症脑损伤的直接机制尚不清楚。
几十年来发生了巨大复杂的变化 患有神经退行性疾病的人。所以还有其他理论也需要继续探索,比如阿尔茨海默病。
这项研究发表于科学进步。