血液的发育一项新的研究表明,依赖于一种看似无关的微生物传感蛋白受体。
这一发现可能会为从人自己的血液中生产造血干细胞的持续探索开辟新天地,从而消除骨髓移植的需要。
该研究的作者指出,这种名为 Nod1 的蛋白质受体因其在帮助识别体内细菌感染和召集免疫反应方面的作用而闻名。
但根据他们的研究,当胚胎的血管系统仍在发育时,Nod1似乎在生命的早期也发挥着不同的作用。
由爱荷华州立大学遗传学家拉奎尔·埃斯平·帕拉松 (Raquel Espin Palazon) 领导的这项研究表明,这种微生物传感器有助于胚胎迫使部分血管内皮细胞转变为造血干细胞。
这可能是很有价值的信息,因为它有可能揭示胚胎如何产生造血干细胞,以及我们如何在以后的生命中培养它们。
Espin Palazon 表示:“这将消除寻找相容的骨髓移植捐献者的挑战性任务以及接受移植后发生的并发症,从而改善许多白血病、淋巴瘤和贫血患者的生活。”说。
血液干细胞是我们血液中所有白细胞和红细胞的祖细胞,在造血过程中产生血液的所有成分。
这些血液干细胞,也称为造血干细胞,在出生前就在体内产生,由胚胎主动脉内的内皮细胞发育而来。
然而,尽管这一点已经很清楚了,但关于是什么触发了胚胎中这一重要过程的细节却很少。
Espin Palazon 表示:“我们知道血液干细胞是由内皮细胞形成的,但使细胞转换身份的因素却是个谜。”说。 “我们不知道需要这种受体,也不知道这么早就需要它,甚至在造血干细胞形成之前。”
研究人员首先通过分析人类胚胎的公共数据库来锁定 Nod1,然后使用斑马鱼进一步研究该受体,斑马鱼是一种常用的模式生物,其基因组大约 70% 与人类相同。
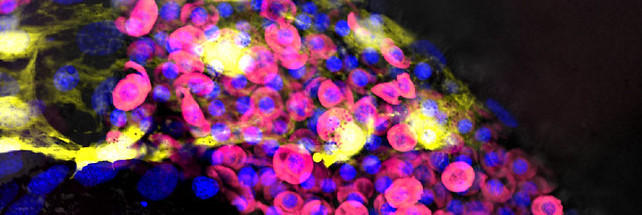
通过抑制或增强Nod1,研究人员证明了其与造血干细胞的产生呈正相关。
为了更多地了解 Nod1 和人类血液发育,该研究的作者还与费城儿童医院合作,该医院的研究人员生产了人类诱导的多能干细胞。
尽管它们是由成体细胞产生的,但研究人员对它们进行了基因重新编程,以模仿胚胎中发现的多能干细胞(能够产生许多不同细胞类型的细胞)。
诱导多能干细胞可以产生大多数类型的血细胞,但它们不能产生功能性造血干细胞。尽管如此,抑制Nod1仍会导致这些诱导多能干细胞产生更少的血液,这与斑马鱼血液干细胞中观察到的效果相似。
人的大部分造血干细胞都存在于骨髓中,因此患有某些血液疾病的患者通常需要骨髓移植来提供重要的造血干细胞供应。
但有了关于Nod1在胚胎中产生造血干细胞的作用的证据,科学家们对设计一种从人类样本(甚至可能是从患者自己的血液)中产生新造血干细胞的方法有了新的希望。
研究人员指出,这不仅有助于避免安排和进行骨髓移植的后勤挑战,还有助于避免移植物抗宿主病等并发症,在这种疾病中,移植的免疫细胞将宿主识别为外来物并攻击受体的细胞。
“这将是再生医学的巨大进步,”埃斯平·帕拉松 (Espin Palazon)说。
研究人员表示,仍然需要更多的研究,不仅要了解身体究竟如何产生造血干细胞,而且还要了解每个步骤需要何时发生。
“时机非常重要。这就像你做饭时需要按特定顺序添加食材一样,”Espin Palazon说。
“我在爱荷华州立大学的团队将继续努力实现没有血液疾病的生活,”她添加。 “我相信我们的研究将为最终创造治疗级血液干细胞来治愈血液疾病患者铺平道路。”
该研究发表于自然通讯。