钚是一种放射性银金属,可用于创造或毁灭。虽然它在制造出来后不久就被用于破坏,但如今该元素主要用于在世界各地创造能源。
纽黑文大学化学工程助理教授阿曼达·西姆森 (Amanda Simson) 表示,钚于 1940 年首次生产和分离,并用于制造“胖子”原子弹,该原子弹于二战结束时投掷在长崎,距离首次生产仅五年。
只是事实
以下是钚的性质,根据洛斯阿拉莫斯国家实验室:
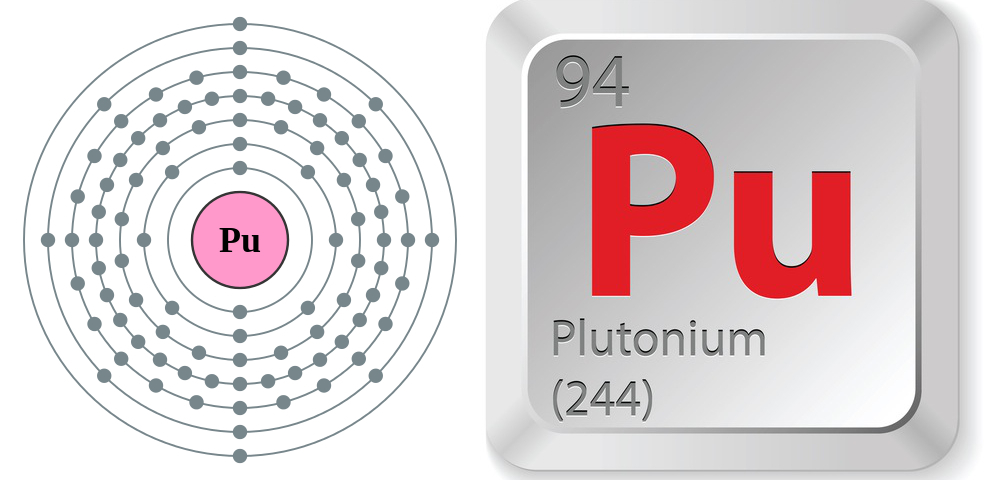
- 原子序数:94
- 原子符号:Pu
- 原子量:244
- 熔点:1,184 F (640 C)
- 沸点:5,842 F (3,228 C)
发现与历史
1941 年,加州大学伯克利分校的科学家 Joseph W. Kennedy、Glenn T. Seaborg、Edward M. McMillan 和 Arthur C. Wohl 发现了钚。这一发现是在研究小组用回旋加速器装置中加速的氘核轰击铀 238 时产生的,产生了镎 238 和两个自由中子。然后镎238通过β衰变衰变成钚238。
直到第二次世界大战后的 1946 年,这个实验才与科学界的其他成员分享。 1941 年 3 月,西博格向《物理评论》杂志提交了一篇关于他们的发现的论文,但当发现钚同位素 Pu-239 可用于制造原子弹时,该论文被删除。
据洛斯阿拉莫斯国家实验室称,很快,西博格被派往芝加哥大学领导钚生产实验室,也称为气象实验室。该实验室的目的是制造钚,作为曼哈顿计划的一部分。曼哈顿计划是第二次世界大战期间的一项秘密事业,专门致力于研制原子弹。
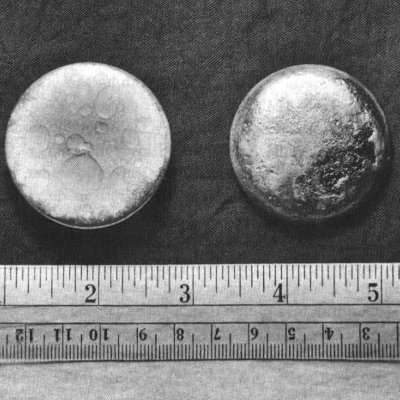
1942 年 8 月 18 日,他们取得了第一次巨大的成功。他们能够制造出肉眼可见的微量钚。它仅相当于 1 微克左右。科学家从微小的样本中确定了钚的原子量。
曼哈顿计划最终为“三位一体测试”生产了足够的钚。 1945 年 7 月 16 日,洛斯阿拉莫斯实验室主任罗伯特·奥本海默 (Robert Oppenheimer) 和陆军上将莱斯利·格罗夫斯 (Leslie Groves) 在新墨西哥州索科罗附近引爆了世界上第一颗原子弹,又称“小玩意”。
谈到这次测试,奥本海默说:“我们知道世界会不一样。有的人笑了,有的人哭了。大多数人都保持沉默。我记得印度教经典《薄伽梵歌》中的一句话。毗湿奴试图说服王子,让他相信他应该履行自己的职责,并给他留下多臂形态的印象,并说:“现在我变成了死亡,世界的毁灭者。”我想我们都这么认为,不管怎样,”根据英国皇家化学学会。
爆炸的能量相当于约2万吨TNT炸药。 1945 年 8 月 6 日,第一颗战争用原子弹落在日本广岛。不过,这颗被称为“小男孩”的原子弹拥有铀核。 1945 年 8 月 9 日在日本长崎投下的第二颗原子弹具有钚核。所谓的“胖子”加速了第二次世界大战的结束。
钚的性质
新鲜制备的钚金属具有明亮的银色,但在空气中氧化时会呈现暗灰色、黄色或橄榄绿色失去光泽。该金属很快溶解在浓无机酸中。由于α衰变释放出能量,一大块钚摸起来很温暖;较大的碎片可以产生足够的热量来煮水。在室温下,α-型钚(最常见的形式)与铸铁一样硬而脆。它可以与其他金属形成合金,形成室温稳定的δ形式,柔软且具有延展性。与大多数金属不同,钚不是热或电的良导体。它具有低熔点和异常高的沸点。
钚可以与大多数其他金属形成合金和中间化合物,并与多种其他元素形成化合物。一些合金具有超导能力,另一些则用于制造核燃料芯块。它的化合物有多种颜色,具体取决于氧化态和各种配体的复杂程度。在水溶液中有五价离子态。
钚以及所有其他超铀元素都具有放射性危害,必须使用专门的设备和预防措施进行处理。动物研究发现,每公斤组织中含有几毫克的钚就足以致命。
来源
钚在自然界中一般不存在。钚的微量元素存在于天然存在的铀矿石中。在这里,它的形成方式与镎类似:用中子照射天然铀,然后进行β衰变。
然而,钚主要是核电工业的副产品。据洛斯阿拉莫斯国家实验室称,每年大约生产 20 吨钚。乏核燃料还可以进行后处理,以将可用的钚与燃料中的其他元素分离。
据美国宇航局称,20世纪50年代和1960年代的大气层武器测试在地球大气层中留下了数吨钚,这些钚至今仍然存在。世界核协会。
用途
在大多数情况下,钚的用途并不多。事实上,在五种常见同位素中,只有两种钚同位素(钚238 和钚239)有任何用途。
Plutium-238 用于使用放射性同位素热电发电机为太空探测器发电。当探测器由于距离太阳太远而无法获得足够的太阳能时,这些发电机就会打开。使用钚 238 的探测器有卡西尼号和伽利略号。
当浓度足够高时,钚239会发生裂变链式反应。正因为如此,它被用于核武器和一些核反应堆。
事实上,钚的最大用途之一是能源。据世界核协会称,大多数核电站生产的能源中有三分之一以上来自钚。钚是快中子反应堆的主要燃料。
谁知道?
几十年来,科学家们一直想知道为什么钚的行为与同族其他金属不同。例如,钚是一种不良电导体,它不会粘在磁铁上。现在研究人员已经弄清楚了它“缺失的磁性”隐藏在哪里,它与元素外壳中电子的古怪行为有关。与其他金属的外壳具有一定数量的电子不同,钚在基态时可以有四个、五个或六个电子。
外壳电子数量的波动解释了为什么钚没有磁性:为了使原子与磁铁相互作用,其外壳中的不成对电子必须排列成一个。 []
钚最稳定的同位素钚244可以持续很长时间。据该机构称,它的半衰期约为 8200 万年,并通过 α 衰变衰变成铀 240。杰斐逊实验室。
钚是以行星冥王星命名的。这是因为它来自以天王星命名的铀和以海王星命名的镎。
钚发射中子、β粒子和伽马射线。
其他资源