CRISPR(CRISPR-CAS9)是一种基因组编辑工具,它允许科学家精确切割和修改DNA序列。它彻底改变了基因的研究,有助于增强作物并改善了医疗保健。
基因编辑系统最初是在细菌,通过剪辑病毒DNA限制感染。然后,在诺贝尔奖- 赢得工作,这种细菌防御机构是由科学家选择的,以设计一种新的基因组编辑方法。
“确实是简单,成本和易用性”使这种编辑工具民主化,Alison van Eenennaam加利福尼亚大学戴维斯分校的牲畜遗传学家告诉Live Science,他使用CRISPR改变了农场动物的遗传学。
最近,CRISPR已被批准治疗两种血液疾病,并且早期试验揭示了其治疗遗传失明的潜力。这是您需要了解的有关开创性技术的所有信息。
有关的:CRISPR“将为以前无法治愈的遗传疾病提供治疗方法。”
什么是CRISPR?
CRISPR系统包括以下主要组成部分:
CRISPR:“ CRISPR”代表“定期间隔短的alindromic重复序列”。这个笨拙的名称描述了在细菌基因组中发现的DNA序列的模式,可以帮助细菌抑制病毒。
“简短的alindromic重复”指的是读取相同前向和向后的序列,例如“皮划艇”和“赛车”。脱氧核糖核酸由两条成对的链组成,在螺旋中互相扭曲。因此,DNA palindrome指的是一串DNA字母,或碱基 - A(腺嘌呤),C(胞质),G鸟嘌呤)和T(胸腺素) - 当向前读取一条链并向后读书时,它们是相同的。
例如,如果一条链在一个方向上读取“ GATC”,则这些DNA碱基将与相对链上的“ CTAG”配对,因为G始终将与C与T始终与T配对。当向后读取时,CTAG成为原始序列GATC。
这些重复是“定期间隔的”,这意味着基因组中的这些CRISPR区包含一种交替的palindromes模式,它们之间的“间隔者”序列在它们之间楔入。细菌选择了从入侵病毒的DNA并将它们存放在其CRISPR地区,以抵抗未来的感染。
这个系统通常是比作人类适应性免疫系统,它类似地存储了先前感染的“记忆”,以避免重复遇到。而不是使用免疫细胞,就像人类一样,细菌使用CRISPR。
CRISPR RNA(CRRNA)和CAS9:CRISPR DNA是过去感染的永久记录,但是要使细菌使用这些序列阻止病毒,它们必须将其转化为DNA的表弟,RNA。通过称为转录的过程,细菌首先将两个CRISPR DNA链之一复制到一个互补的链rna;链是互补的,因为它与原始DNA代码匹配,除非它用U(Uracil)代替T。然后,微生物将长链切成较短的crrna片段,每个片段都携带一个重复和一个垫片。
细菌还形成了第二个RNA分子,称为“反式激活CRRNA,“或tracrrna。此RNA在CRRNA分子上包含重复的反向版本,从而使两个RNA结合在一起。
然后,所得的复合物可以锁定在带有间隔序列的病毒DNA上,呼吁切割和禁用该DNA的酶。该酶,称为“ CRISPR相关蛋白9”或Cas9,本质上是一对分子剪刀。
也有其他类型的CAS酶可以在基因编辑中使用。例如,一个叫CAS12A产生交错的切口在DNA中,其中一条链比另一端更长。然后可以将DNA序列与悬垂链配对。CAS14在RNA中切割,而不是DNA,对于暂时改变细胞制造的蛋白质而不对其基因组进行永久编辑可能是有用的。
有关的:认识“扇形”,这是复杂生活中发现的第一个类似CRISPR的系统
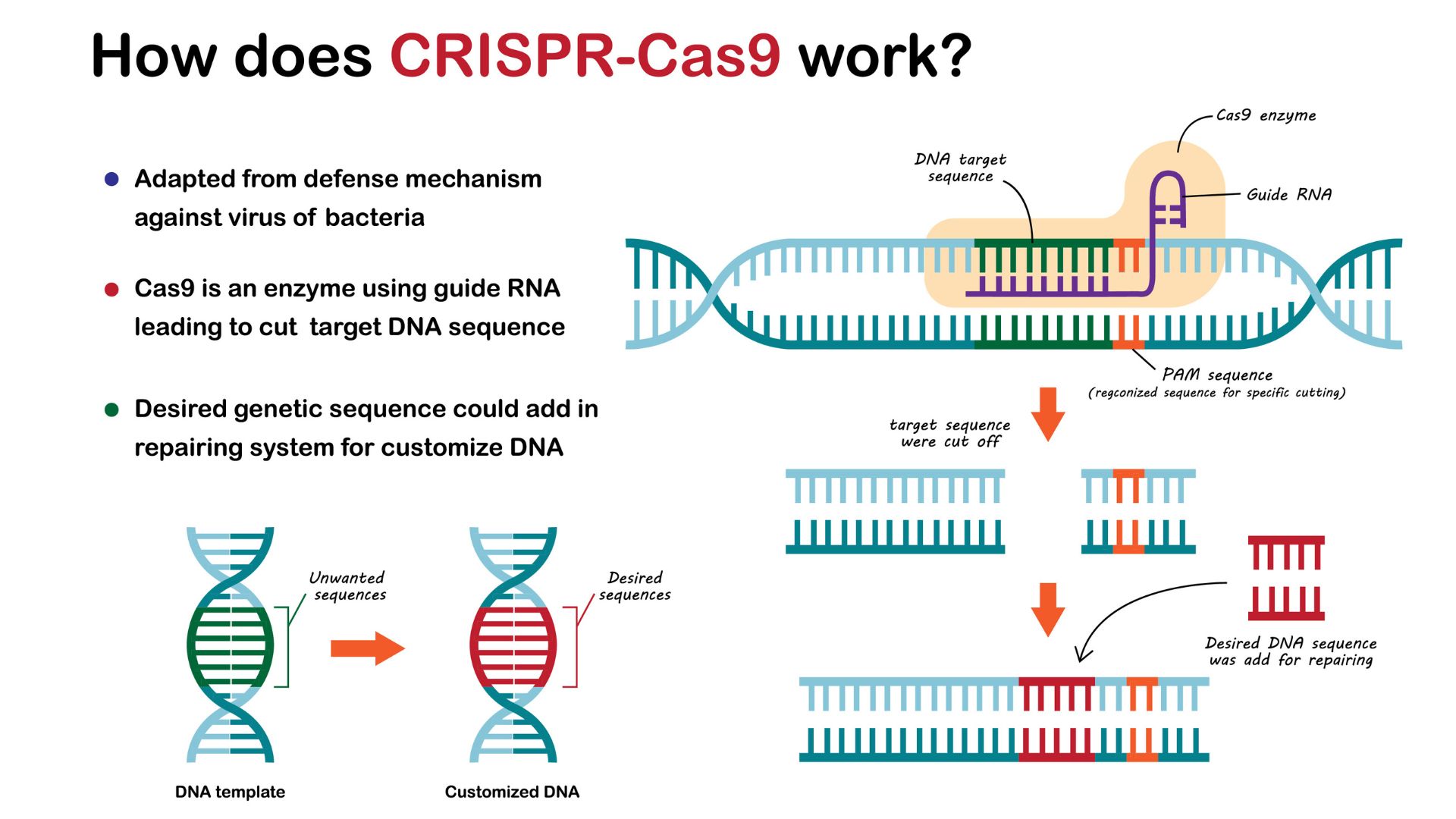
CRISPR如何编辑DNA?
研究人员利用了CRISPR系统在DNA中进行精确削减的能力。经过适应CRISPR来进行理想的基因组编辑在任何细胞类型中,研究人员都可以改变调节基因活性,改变其功能或表达的基因或DNA序列。
为了简化系统,科学家将crrna和tracrrna分子结合在一起在上一节中描述为称为“指导RNA”的单个分子。
范·埃涅纳姆(Van Eenennaam)说:“要针对新序列,您需要做的就是改变指南。”相比之下,其他基因组编辑技术需要针对感兴趣序列的实验室制造蛋白的耗时且昂贵的设计。
引导RNA与CAS9酶配对以在基因组中进行编辑。一旦RNA结合了所需的序列,酶就会散入并切割两个DNA的链。作为响应,该单元试图将链粘合在一起,但它使用了故障的过程这通常会引入突变。例如,它可能会添加一些额外的字母。这种变化通常会停用基因,使CRISPR编辑成为关闭基因的简单策略。
科学家还修改了CAS9酶以进行其他类型的编辑。通过禁用Cas9的遗传剪刀,然后将此“死亡Cas9”融合到另一个酶,他们可以将机械装置为改变单个基础,例如,将C转换为T。这种CRISPR的表述称为“基础编辑,“它使研究人员可以进行细微的变化,以改变由基因编码的产物的结构,无论是蛋白质还是RNA。
Dead Cas9也已与酶配对激活或者沉默基因调整其活性。死去的cas9也一直融合到荧光蛋白,当引导RNA结合到特定的DNA时,它会点亮,从本质上揭示其在细胞中的邮政编码。
谁发现了CRISPR?
CRISPR的历史可以追溯到1987年Ishino Yoshizumi日本大阪大学的同事首先报道了异常重复的序列在他们表现出寒意,一种众所周知的细菌。当时,科学家不知道这些簇与细菌防御有何关系。
在1990年代,这些集群引起了更多科学家的注意弗朗西斯科·莫吉卡(Francisco Mojica)(WHO创造了“ CRISPR”一词)和他在西班牙阿利坎特大学的团队发现了他们20其他细菌基因组,表明它们在细菌中广泛重要。
2005年亚历山大·博洛汀(Alexander Bolotin)法国国家农业研究所的同事遇到了CAS酶的基因位于基因组的CRISPR地区附近。不久之后,尤金·科旺(Eugene Koonon)的美国国立卫生研究院的小组揭示了间隔序列匹配的病毒DNA,导致研究人员将CRISPR与细菌免疫联系起来。
Emmanuelle Charpentier,德国的马克斯·普朗克学院詹妮弗·杜德纳(Jennifer Doudna)加利福尼亚大学伯克利分校,后来改编了CRISPR进行基因组编辑。他们的工作使他们分享2020诺贝尔化学奖。
在《夏尔潘蒂尔》和《杜德纳的作品》的开创性出版后不久,弗吉尼亚斯·šikšnys维尔纽斯大学生物技术学院及其同事还展示了CRISPR如何用于基因编辑中。Feng Zhang'sBroad Institute的小组后来将其他CRISPR系统开发为基因编辑工具,包括RNA编辑系统涉及一种称为CAS13的酶。

CRISPR是如何使用的?在动植物中呢?
CRISPR已用于纠正遗传疾病,例如囊性纤维化和白内障,在实验室生长的细胞和实验室动物中。它还显示了最近在人类试验中对其他疾病的治疗方法的成功。值得注意的是,英国和美国都有批准了一种基于CRISPR的基因疗法,称为Casgevy针对两种血液疾病:镰状细胞病和β丘脑贫血。这是有史以来第一次基于CRISPR的疗法。
Casgevy通过切割和禁用基因来起作用Bcl11a,可以控制出生后不久从胎儿血红蛋白到成年血红蛋白的转变。
胎儿版本更强烈地与氧气结合,允许胎儿从母亲的血液中收集足够的氧气。成人版本通常在出生后接管,一旦可以通过呼吸获得氧气。然而,在镰状细胞疾病和β地中海贫血中,人们的成人基因有故障。 Casgevy逆转转向成年血红蛋白的转换,以便患者可以继续使用其胎儿血红蛋白基因。
一种继承的失明形式可能是使用CRISPR治疗的下一个疾病之一。试验的早期试验将CRISPR组件注入眼睛并建议采取安全有效模式的方法。 CRISPR的基础编辑形式也显示有希望的结果可以降低胆固醇水平在一次小型试验中。
除了医疗保健之外,CRISPR编辑至少已用于增强41种食物作物,包括大米和小麦,通过改善其可口性,营养价值和对疾病的抵抗力。也已经习惯了编辑猪的基因然后将其器官用于人类移植操作。
此外,Van Eenennaam在概念验证实验中使用CRISPR来赋予养殖动物具有理想的特征。例如,她增强肉产量在牛中,农民可以养成更少的牲畜,从而限制其环境影响。
CRISPR的潜在危险和缺点是什么?
CRISPR是一种多功能且功能强大的基因组编辑工具,但是在这个关头,它有一些局限性和风险,还提高了道德上的难题。
例如,关于治疗遗传疾病,有些人拥护自己的状况和不要将它们视为疾病,范·埃涅纳(Van Eenennaam)说。例如,“您应该在一对不相信耳聋是坏事的聋人后代中'治愈'遗传性耳聋吗?”她质疑。
关于CRISPR的局限性,如果CAS9酶在基因组的意想不到的位置切开DNA,它可能会引入“脱靶效应”。如果研究人员不为独特的DNA靶标的指南RNA序列定制,而是针对基因家族中发现的常见序列,则可能发生这种情况。这种非目标效应可能会对健康产生负面影响。例如,如果引导RNA与抑制肿瘤生长的基因相匹配,则有可能使其变为细胞癌的风险。
另一个问题是CRISPR编辑是不是100%效率,因此只有一定比例的靶向细胞会经历所需的遗传变化。这意味着,在某些情况下,未经编辑的细胞可能会避免有害的脱靶效应,因此比编辑的细胞更好,最终超过了它们。研究人员最近发现 编辑的血液干细胞可以加班死亡,提示血液疾病的治疗可能在长期以来的效果下变得降低。
这些风险也对在牲畜中使用CRISPR的使用构成了道德上的考虑。 Van Eenennaam通常使用”种系编辑在牲畜中,涉及靶向性细胞,例如鸡蛋和精子或受精卵。这使得CRISPR在动物和其后代之间可以遗传。VanEenennaam的群体并未将新工程的基因插入牛,而是将现有的,可取的基因转移到另一头牛中。
有关的:基因疗法:它是什么,它如何工作?
脱靶编辑有可能会损害动物的健康。但是范·埃涅纳(Van Eenennaam)认为,这些担忧常常被夸大。她解释说:“两只公牛之间将有数百万个遗传变异。
尽管如此,美国食品药品监督管理局(FDA)说养殖动物的基因组编辑需要充分的监督,部分原因是其他DNA序列通常伴随着插入基因组的新基因。 FDA说,应审查这些结转,以确保它们对动物或人类消费者没有危害。如果该机构认为被编辑的动物是低风险的,他们可以授予”执法酌处权范·埃涅纳(Van Eenennaam)指出:“这使其及其后代可以成为商业化。
这类种系编辑很少用于人类,除了在有争议的情况下中国科学家臭名昭著地产生了“ CRISPR婴儿”违反法规。避免人类种系编辑的一个重要原因是,子孙后代不能同意接受CRISPR治疗。
子孙后代也不能同意有害的脱靶效应的可能性,例如可能使癌症患者容易产生的突变。尼塔牛群,杜克大学的生物伦理学家,告诉《纽约时报》编辑胚胎将是不道德的:“直到我们能弄清楚靶向效果是什么,以及如何控制它们。”
美国国家科学,工程和医学学院制定了标准,这些标准应符合生殖线编辑临床试验的前进。小组建议限制人类种系编辑对于那些突变的基因可以导致严重的疾病,没有其他疗法。
目前,基因疗法主要使用一种称为“躯体编辑。”
Van Eenennaam说:“好处显然超过了任何假设的风险”,因此,在基因疗法方面,体细胞CRISPR编辑是“不费吹灰之力的”。
编者注:本文的新版本于2024年7月1日发布。上一版本是在2023年3月进行的。
曾经想知道为什么有些人比其他人更容易建立肌肉或者为什么雀斑在阳光下出来?向我们发送有关人体如何工作的问题[email protected]有了主题行“ Health Desk Q”,您可能会在网站上看到回答的问题!