科学家可能已经找到了一种自然调节血糖水平和对糖的渴望的方法,其方式与 Ozempic 等药物类似。
在小鼠和人类中,发现解锁这一自然过程的关键是肠道微生物及其代谢物——它在消化过程中产生的化合物。
中国江南大学的一个团队领导的研究人员通过增加糖尿病小鼠体内这种肠道微生物的丰度,显示它们可以“协调胰高血糖素样肽-1 的分泌”。
胰高血糖素样肽-1 (GLP-1) 是一种由人体自然产生的激素,有助于调节血糖水平和饱腹感。 GLP-1 的释放受到某些食物和肠道微生物的刺激,其作用机制类似于索马鲁肽(Ozempic 背后的成分)等药物。
2 型人士通常 GLP-1 功能受损,导致血糖控制问题,这就是 Ozempic 和其他 GLP-1 激动剂作为治疗药物的原因。
这些药物模仿体内的自然过程,虽然它们已被证明非常有效,但一些研究人员希望弄清楚如何让身体自行产生更多的 GLP-1。
“越来越多的研究表明,我们对饮食成分的渴望源于肠道发出的信号,肠道是传递饮食偏好的关键器官,”解释作者们。
“然而,目前尚不清楚肠道微环境中哪些基因、肠道菌群和代谢物参与糖偏好的调节。”
新研究表明肠道微生物如普通拟杆菌它们的代谢物可能有助于塑造一个人对甜食的喜爱。
在实验中,如果小鼠不能产生一种名为 Ffar4 的肠道蛋白,研究人员发现肠道菌落B、流行缩小了。这反过来又减少了一种名为 FGF21 的激素的释放,这种激素与对糖的渴望有关。
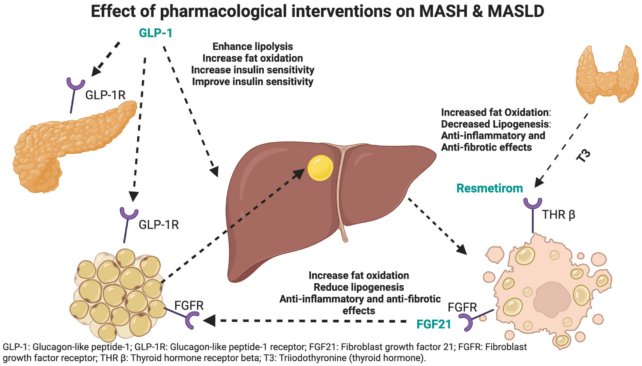
在对服用 GLP-1 激动剂的小鼠进行的研究中,研究人员发现成立这些药物会刺激 FGF21。
与此同时,在人类中,一些研究研究表明,具有 FGF21 激素基因变异的人成为甜食顶级消费者的可能性要高出约 20%。
中国的研究人员对 60 名 2 型糖尿病患者和 24 名健康对照者进行了血液分析,发现 Ffar4 突变会减少 FGF21 的产生,与对糖的偏好增加有关,“这可能是导致糖尿病发展的重要因素”。糖尿病。”
更重要的是,肠道微生物组可能是该过程的关键介质。
果然,研究小组发现,当小鼠接受代谢物治疗时B、粗俗,它促进了 GLP-1 的分泌,进而引发了 FGF21 的分泌。
总之,这意味着小鼠的血糖控制能力更强,对糖的渴望更少。
同样的情况是否会扩展到人类还有待观察,但作者宣称他们的研究“提供了预防糖尿病的策略”。
该研究发表于自然微生物学。