这是我们对与阿尔茨海默病相关的蛋白质进行的最近距离的观察
 原纤维横截面。图片来源:于利希研究中心 / HHU 杜塞尔多夫 / Gunnar Schröder
原纤维横截面。图片来源:于利希研究中心 / HHU 杜塞尔多夫 / Gunnar Schröder
研究人员拍摄了迄今为止最有价值的照片淀粉样原纤维可以在体内形成的固体蛋白质聚集体与疾病相关,例如。
借助新的高分辨率原子级扫描,科学家们希望能够更好地了解阿尔茨海默病如何在大脑中扎根,以及如何阻止这些原纤维扩散。
这个最新模型显示了复杂的相互作用和精确的位置β淀粉样蛋白来自德国和荷兰的研究人员说,(Aβ)蛋白质形成原纤维,这是我们以前无法如此仔细地观察的。
“这是基本了解淀粉样蛋白结构和相关疾病道路上的一个里程碑,”团队成员之一说道,来自德国杜塞尔多夫海因里希·海涅大学的迪特尔·威尔博尔德(Dieter Willbold)。
“原纤维结构回答了有关原纤维生长机制的许多问题,并确定了导致阿尔茨海默病早期发作的一系列家族突变所起的作用。”
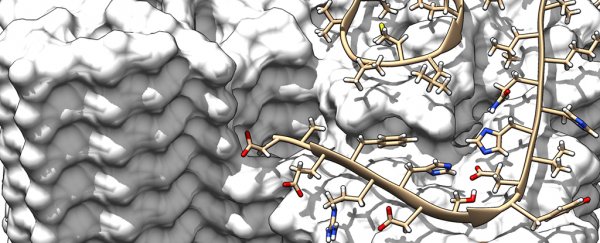
 形成原纤维的两根原丝的示意图。图片来源:于利希研究中心 / HHU 杜塞尔多夫 / Gunnar Schröder
形成原纤维的两根原丝的示意图。图片来源:于利希研究中心 / HHU 杜塞尔多夫 / Gunnar Schröder
淀粉样原纤维是编造的来自天然存在的蛋白质,这些蛋白质通常是可溶的,但可能会误入歧途并相互啮合形成不溶性纤维。
就阿尔茨海默氏症而言,这些纤维斑块在神经细胞和神经细胞之间形成是主要嫌疑人导致与疾病相关的细胞死亡和组织损失。
为了详细了解这些原纤维,研究人员利用了冷冻电子显微镜设施,其使用率极低(低温的)温度,使原子保持在适当的位置并在不干扰其自然状态的情况下进行测量。
额外读物来自固态核磁共振(核磁共振)光谱和X射线衍射实验有助于验证数据和原子结构,生成我们见过的最准确的计算机渲染,分辨率低至 4埃或0.4纳米。
“冷冻电子显微镜中的单个图像通常非常嘈杂,因为蛋白质对电子辐射非常敏感,并且图像只能在非常低的辐射强度下生成,”一位研究人员解释道Gunnar Schröder,同样来自杜塞尔多夫海因里希海涅大学。
这一突破是通过扫描和分析多个具有相同形状和对称性的原纤维来实现的,该团队通过限制它们的生长来实现这一目标。这意味着可以将数千张相似的图片组合起来进行 3D 扫描。
它发现了一些有用的发现,比如单个 Aβ 蛋白分子彼此交错分层的方式。其中两个所谓的原丝可以结合形成原纤维,然后几个缠结的原纤维形成斑块。
换句话说,这些缠结的原丝中的各个分子是交错的,就像拉链一样,将它们锁定在适当的位置。
新的高分辨率扫描还显示了单个 Aβ 蛋白分子的所有 42 个氨基酸残基的位置和结构。这反过来可能有助于解释遗传变异如何影响患阿尔茨海默病的机会——不同的 Aβ 蛋白变异显然会改变原纤维的稳定性。
我们知道老鼠不要得阿尔茨海默氏症我们知道冰岛有一小部分人口似乎免疫新的图像可以为科学家提供有关其遗传原因的线索。
关于阿尔茨海默氏症,我们还有很多不了解的地方,但我们取得进步,而新的淀粉样原纤维图像应该有助于为未来几年的阿尔茨海默病和相关疾病的研究提供信息。
该研究发表于科学。