停止的关键可能与从未患过这种疾病的女性同眠。
尽管有很强的遗传风险,一名携带两份与晚发有关的罕见基因变异的女性基督城的一种名为 APOE3 的药物似乎能够抵抗这种认知能力下降的疾病。
现在,科学家们观察了具有类似基因突变的小鼠如何对类似阿尔茨海默病的情况做出反应。
与人类的情况类似,小鼠与疾病晚期相关的神经系统缺陷似乎较少,关键因素是大脑清洁细胞的方式。小胶质细胞)对疾病的病理作出反应。
这为开发专注于引发这些特定反应的阿尔茨海默氏症治疗方法带来了新的希望。
华盛顿大学医学院的研究小组表示,这种反应有助于打破阿尔茨海默病的早期无症状阶段与认知能力下降的晚期阶段之间的联系。
两者遗传? 被称为常染色体显性遗传阿尔茨海默病(ADAD)? 非遗传性阿尔茨海默氏症大约需要 30 年的时间才能形成。 前 20 年左右没有任何症状淀粉样蛋白积聚慢慢地在脑中。
当大脑中的淀粉样蛋白水平达到临界点时,几个破坏性过程开始协同作用。 一种叫做 tau 的蛋白质 并扩散,减缓大脑的新陈代谢,导致组织萎缩,导致认知能力下降。
“阿尔茨海默病领域最大的悬而未决的问题之一是为什么淀粉样蛋白积累会导致 tau 蛋白病理学,”神经学家 David Holtzman 说道。说。
“任何保护因素都非常有趣,因为它为我们提供了了解这种疾病如何发生的新线索。”
哥伦比亚的一个大家庭几代人都患有 ADAD,其中一半的家庭成员在 40 多岁时开始出现症状。 在这个家庭的案例中,这种疾病是由一种称为“基因突变”的基因突变引发的。早老素-1,与形成趋势增加有关淀粉样斑块,淀粉样蛋白从 20 岁左右开始积累。
这个家庭中的一个人实现了看似不可能的事情:她在 70 多岁时仍保持认知健康,尽管她继承了早老素-1突变。
该女子似乎是这群人中唯一拥有两份 APOE3 Christchurch (APOE3ch) 副本的人,这被认为是她好运的解释。 那些只携带一个 APOE3ch 拷贝的人在年轻时仍然表现出认知能力恶化的迹象。
这名女性的额外突变减缓了 tau 蛋白的快速扩散,从而延迟了这一过程。
“这位女士非常非常不寻常,因为她患有淀粉样蛋白病理,但没有太多 tau 蛋白病理,并且只有非常轻微的认知症状,而且是晚期出现的,”霍尔茨曼解释。 “这向我们表明,她可能掌握着淀粉样蛋白和 tau 蛋白之间联系的线索。”
但由于这组特定的基因突变仅在世界上一个人身上有记录,因此无法确定是否她出色的认知健康状况可能还与其他因素有关。
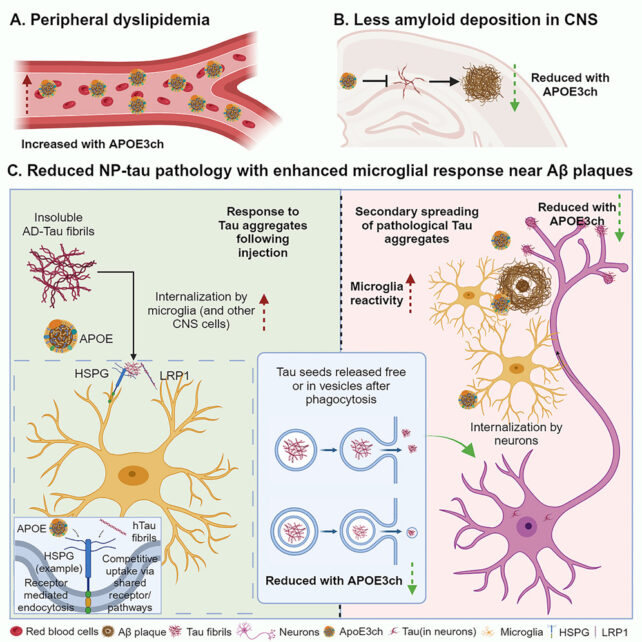
因此 Holtzman 和同事研究了经过基因改造以产生过量淀粉样蛋白的小鼠,并引入了带有 APOE3ch 突变的基因。 然后他们注射了少量的 tau 蛋白? 预计会对已经充满淀粉样蛋白的大脑造成问题。
在小鼠模型中,就像哥伦比亚女性的例子一样,tau 蛋白并没有按预期扩散。 原因是:淀粉样蛋白斑周围的小胶质细胞在清理蛋白质方面非常活跃且高效。
“这些小胶质细胞正在吸收 tau 蛋白并在 tau 蛋白病理学有效扩散到下一个细胞之前将其降解,”说霍尔兹曼。
“这阻碍了大部分下游过程;如果没有 tau 蛋白病理学,你就不会出现神经退行性变、萎缩和认知问题。”
不过,APOE3ch 对晚发性阿尔茨海默氏症的保护作用尚不清楚,并且可能会因人的血统或是否涉及其他基因突变而有所不同。 该团队补充说,这是一个需要进一步研究的重要领域。
“如果我们能找到一种方法来模拟 APOE 基督城突变的影响,”Holtzman说”,“我们也许能够阻止那些已经患上阿尔茨海默氏痴呆症的人继续走这条路。”
该研究发表于细胞。









