玛格丽特·基南(Margaret Keenan)在她91岁生日的前几天,成为世界上第一个接受临床试验以外的pfizer-Biontech Covid-19疫苗的人。
基南(基南病毒现在,这已经感染了全球至少7000万人,并造成150万人丧生。一位名叫威廉·莎士比亚(William Shakespeare)的81岁年轻人接下来是疫苗。
基南(Keenan)和莎士比亚(Shakespeare)也是审判环境之外的第一批人,可以使用一种利用“ mRNA”技术的疫苗。这种相对较新的技术,依赖于称为Messenger的遗传密码的合成链RNA(mRNA)为免疫系统加油,尚未获得任何以前的批准疫苗在世界上。
有关的:冠状病毒实时更新
但是19岁大流行专家告诉Live Science,它是mRNA疫苗的意外概念证明,该疫苗有可能在未来重塑疫苗生产。实际上,辉瑞(Pfizer)和现代(ModernA新冠病毒导致COVID-19。

在星期四(12月10日),一组专家小组投票并建议食品药品监督管理局(FDA)授予辉瑞疫苗的紧急批准,或允许其在紧急情况(如紧急情况)之前进行全额批准之前进行分配大流行。该小组将于12月17日评估现代疫苗。美国的医疗人员和弱势人士最早可以在下周接收辉瑞疫苗。
Covid-19确实为与未来病原体作斗争的新疫苗(例如mRNA疫苗)的快速生产真正“奠定了基础”。 “借助我们为SARS-COV-2开发的技术,我们可以很容易地将其转移到其他新兴病原体上。”
这是mRNA疫苗的工作方式,以及为什么它们可以对疫苗开发产生如此不同的影响。
利用自然过程
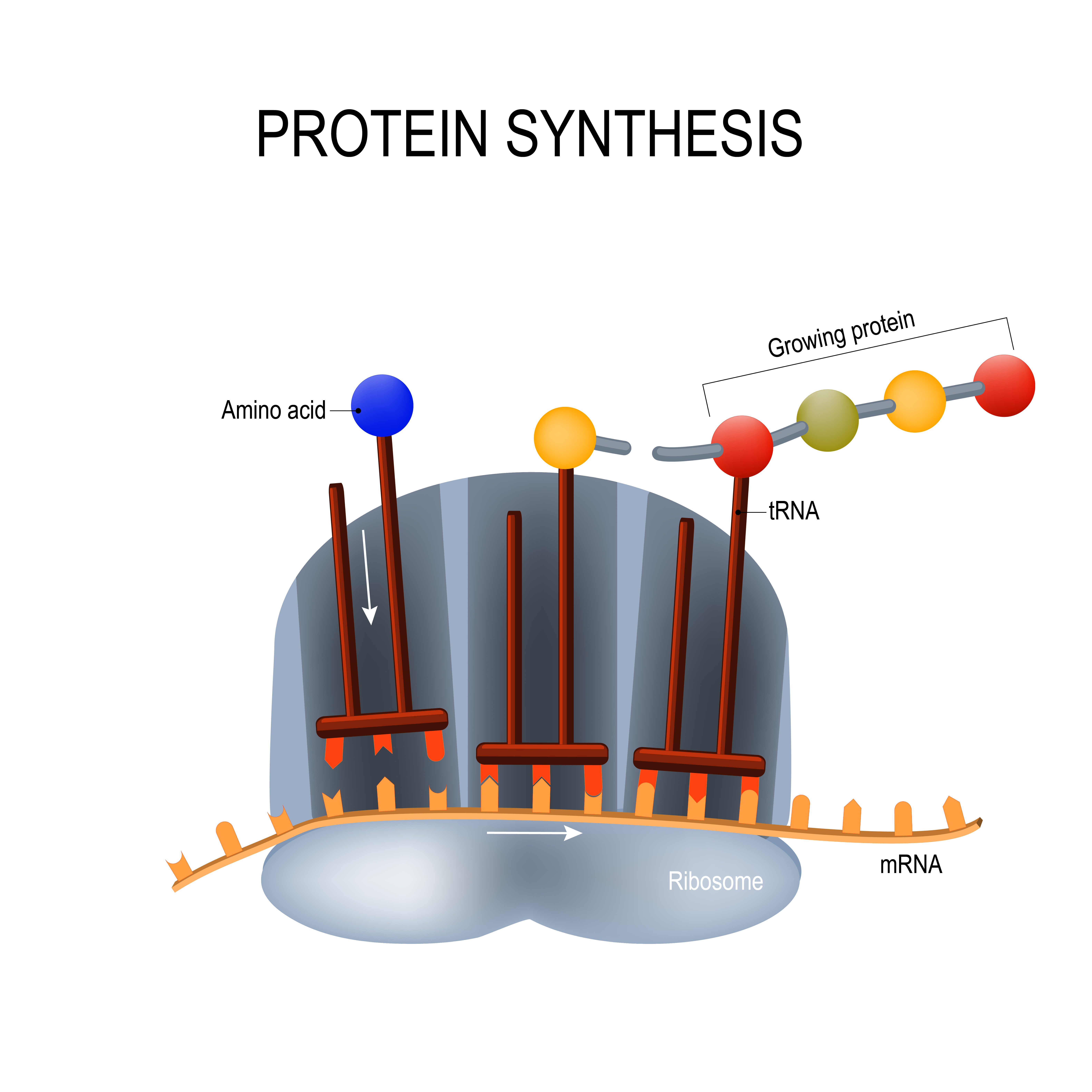
mRNA疫苗受到基本启发生物学。
单元存储DNA,该DNA持有编码的说明蛋白质。当细胞需要制作蛋白质时,它将适当的指令复制到信使RNA分子上 - 一条遗传物质。然后,一种称为核糖体的蜂窝计算机沿该代码运行,读取它,并射出正确的构件以制成蛋白质。蛋白质是身体的重要工人,形成细胞的结构,制造组织,加油化学反应并发送信息:没有它们,一切都会关闭。
大约三十年前,科学家意识到他们可以在实验室中合成mRNA,将其传递到人类细胞中,并利用身体制造任何想要的蛋白质,例如可以帮助抗击从癌症到呼吸系统疾病的体内各种疾病的蛋白质。 1990年,威斯康星大学和生物技术公司Vical Incorporated的研究人员弄清楚了如何制作可以指导小鼠细胞创建蛋白质的mRNA,根据业务内部人士。
在1990年代,出生于匈牙利的科学家卡塔琳·卡里科(KatalinKarikó免疫系统会认为合成的mRNA外源并破坏它,有时甚至会产生危险的炎症反应。十年后,在宾夕法尼亚大学(Karikó)和她的合作者德鲁·韦斯曼(Drew Weissman)博士工作时,他们发现他们可以通过将mRNA代码的一件稍作改动的mrna代码来创建合成mRNA的隐身斗篷根据STAT新闻。根据STAT News的报道,该微小的编辑允许合成mRNA直接进入细胞而不会引起免疫系统,这一发现是研究人员从2005年开始发表的多个论文中发表的发现。这些结果引起了两位主要科学家的注意:一位后来帮助建立了Moderna,另一个帮助建立了Biontech。
最初,没有一家公司都打算开发针对感染性疾病的mRNA疫苗,但最终开始使用mRNA流感,巨细胞病毒和寨卡病毒发育或临床试验中的疫苗。但是随后,致命的病毒为在大批人中测试了这项技术的强大程度。
1月10日,中国研究人员在网上的预印本上首次发表了小说冠状病毒的遗传序列。在一周之内,韦斯曼及其团队在宾夕法尼亚大学已经开发了针对该病毒的合成mRNA,现代和辉瑞公司都从宾夕法尼亚大学获得了该团队的表达,这是根据9月3日在9月3日发表的观点。贾马。
在序列发布后的66天内,现代人与美国国家过敏和传染病研究所合作开发了一种疫苗,并开始了第一次针对Covid-19的美国临床试验进行了测试。
目前正在临床试验中的五种疫苗是mRNA疫苗。尽管它们是由不同的食谱制成的,但它们使用相同的基本概念。
Moderna和辉瑞的疫苗都由合成mRNA组成,该mRNA包含峰值蛋白的代码。 mRNA被包裹在脂肪纳米粒子中,该脂肪纳米颗粒充当特洛伊木马,渗透人类细胞并传递尖峰建筑说明,而无需唤醒免疫系统。一旦细胞持有mRNA,它们就会产生尖峰蛋白,从而触发免疫系统以产生细胞武器以对抗尖峰蛋白,从而保护人体免受SARS-COV-2的影响。
“模仿病毒感染”
现代和辉瑞开发的疫苗可能是如此成功,因为它们“模仿了病毒感染”,通过激活体内的两个主要免疫反应。
最著名的响应涉及抗体:细胞排出它们制造的尖峰蛋白;杨告诉《 Live Science》,这些触发了免疫系统以对它们产生抗体。在血液,组织和液体中发现抗体,但它们无法进入已经在细胞内部的病毒,因此免疫系统进化出一种处理方法,” Yang说。
有关的:14个冠状病毒神话被科学破坏
该反应涉及杀手T细胞,也称为CD8 T细胞。这些杀手扫描细胞表面 - 细胞在表面上显示出所有蛋白质的小部分 - 并破坏被病毒感染的蛋白质。 SARS-COV-2疫苗还可以挥动杀手T细胞的警告标志:在mRNA提示细胞制造峰值蛋白后,细胞在其表面上显示出经过处理的片段。
这使mRNA疫苗比更传统的疫苗(例如流感或狂犬病,是由实际病原体或其靶蛋白的杀死版本制成的。杨说,杀死的病毒疫苗无法进入细胞,因此它们会引发抗体,但不会引发杀手T细胞的反应。
但是,mRNA疫苗并不是唯一引发这两种免疫反应的疫苗。杨说,牛津大学疫苗是由一种弱化的冷病毒制成的,称为腺病毒,该病毒感染了黑猩猩。该腺病毒经过基因修饰,无法在体内复制并包括峰值蛋白的遗传代码。这些疫苗还促使细胞创建蛋白质本身,而不是提供已经制造的蛋白质。并且由于细胞制成蛋白质,因此它们在表面上显示它们的碎片。
专家告诉Live Science,像牛津疫苗这样的疫苗在疫苗开发的未来中也表现出巨大的希望。根据JAMA的观点,与mRNA疫苗相比,已经对这种载体疫苗进行了广泛的研究。但是,用阿斯利康开发的牛津疫苗比mRNA疫苗的疗效较少。在晚期临床试验中,牛津疫苗有效62%,可在参与者中预防COVID-19,这些参与者被给予了两次全剂量,有效地保护了那些首先给予半剂量的人,然后是全剂量,然后是全剂量。柳叶刀。
目前尚不清楚为什么,但是一种主要可能性是,当人们获得最初的全剂量时,牛津疫苗可能会压倒免疫系统。除峰值蛋白外,腺病毒还具有自己的蛋白质。因为所有这些蛋白质对身体都是陌生的,所以免疫系统会对所有这些蛋白质产生防御能力。杨说:“免疫系统绝对没有任何指导,'好吧,我只应该对Spike做出回应。'另一方面,mRNA疫苗的目标更为有针对性,告诉免疫系统仅对峰值蛋白有反应。
但是,在我们可以说mRNA疫苗在根本上比其他选择要好,Yang说,科学家需要从试验中查看详细的数据,而不是从“新闻稿中的摘要”中收集信息。尚不知道mRNA疫苗诱导的免疫反应将持续多长时间。话虽如此,mRNA疫苗是“第一种使我们[使杀手t细胞反应]不给予整个活病毒的技术。”他补充说,虽然很少见,却活着但弱化的病毒疫苗会导致更严重的疾病,而据我们所知,mRNA疫苗没有。
Shivkumar说,mRNA疫苗不会集成到我们的DNA中(DNA存储在一个称为The Nucleus的细胞内核中,这是合成mRNA不存在的地方),几天后,mRNA通常会降解。
在辉瑞疫苗对数千人服用的第一天,有两名患有严重过敏反应史的人具有过敏反应的症状,促使英国的监管机构警告严重过敏的人,以避免接受该特定的疫苗。但是专家说,普通人群不应焦虑地获取这种疫苗,这并不是完全出乎意料的,因为多种疫苗可能会发生过敏反应,现场科学报道。
伊利诺伊州微生物学和免疫学系的助理教授贾斯汀·里奇纳(Justin Richner)说:“我认为mRNA疫苗与其他疫苗相比,MRNA疫苗发生严重的过敏反应的可能性更大。”试验看起来与其他疫苗非常相似。他说:“如果有的话,我会预测,mRNA疫苗的过敏反应较小,因为产量不需要像其他疫苗那样需要卵。” (大多数流感vaccines是使用鸡蛋制成的,以便它们可以包含一块卵子蛋白,据CDC称)。
交换代码
mRNA疫苗的另一个巨大优势是它们可以很容易地被开发。
里奇纳说:“ mRNA平台的优点在于,您可以轻松地交换遗传密码。”从理论上讲,如果科学家知道在病毒上靶向的蛋白质以阻止其感染人类细胞(例如SARS-COV-2的Spike蛋白),他们可以使用用于其他疫苗开发的相同平台,例如Covid-19-19s疫苗,例如诸如Covid-19疫苗,例如将代码与新蛋白质代码交换为Spike蛋白。
里奇纳说,真正的问题在于找到正确的目标。
因为科学家以前已经对类似的研究进行了研究冠状病毒Richner说,那些引起严重的急性呼吸综合症(SARS)和中东呼吸综合症(MERS)的人 - 他们早就知道峰值蛋白可能是最佳靶标。但是,他们可能对其他病毒并没有那么幸运,因为以前的失败(例如艾滋病毒)已经透露。
与传统疫苗相比,mRNA疫苗更便宜,更容易开发,从理论上讲,更容易扩展。 Shivkumar说,这是因为较旧的疫苗技术依赖于实验室中的病毒或蛋白质的种植。传统疫苗通常在卵或细胞中生长,然后削弱或杀死。
里奇纳说:“在获得病原体的知识之后,研究人员可以在大约一周内合成并准备好mRNA疫苗。 “对于传统的疫苗开发,此过程至少要花费一个月,通常需要几个月。”
Richner说,MRNA是一种可以在工厂环境中制造的化学物质(例如在试管或储罐中)“相对容易”,一旦建立了管道。 “制造业将成为未来的巨大优势。”他补充说,辉瑞最近经历了生产延迟,但这些延误只是“因为这是第一次将mRNA疫苗延长到这种规模上。”
尽管如此,这种简单的遗传交换并不是mRNA疫苗的唯一能力,因为腺病毒载体疫苗也具有此优势。 Shivkumar说:“牛津疫苗更传统,但同样,它与传统疫苗相同,因为它具有相同的骨干。”她说,在大流行之前,正在开发牛津疫苗的组织正在使用导致MER的冠状病毒的疫苗进行疫苗,因此“实际上它们只是将SARS-COV-2序列交换为同一主链。”但是,借助腺病毒载体疫苗,科学家仍然必须依靠较慢的生物学过程,即在实验室中种植腺病毒。
从理论上讲,mRNA疫苗可以应对任何病毒 - 根据JAMA的观点,有一天甚至可以立即解决多种病原体。但是实际上,当面对各种新病毒时,我们不知道这些疫苗会变得多么普遍。加利福尼亚州斯克里普斯研究所的免疫学和微生物学教授丹尼斯·伯顿(Dennis Burton)说,SARS-COV-2“不是特别困难的病毒”。可能会有更严格的测试,然后您将能够更好地判断RNA疫苗的普遍疫苗。尽管如此,“每一个机会” mRNA可能确实是革命性的,但是我们需要更多信息,然后我们可以确定,他告诉Live Science。
无论哪种方式,无论遗传信息多快可以从mRNA疫苗中交换和退出,“您都不能跳过所有的安全数据,” Richner说。里奇纳说,“放缓总是会成为临床试验。”
极性温度

尽管他们承诺,mRNA疫苗仍然存在一些局限性。例如,目前,辉瑞的mRNA疫苗必须存储在负94华氏度的极性温度下(负70摄氏度)。 Shivkumar说:“尤其是在发展中国家和不可能在各地减去80个冰柜的国家,我认为这仍然不是理想的,因此您仍然需要依靠更传统的疫苗。”
Moderna的疫苗可以存储在负4 F的冰柜温度下(减去20 C)。两种疫苗之间的存储要求差异可能取决于公司用来制造的食谱。杨说,超冷的温度可以保持纳米颗粒壳或mRNA更稳定。
但是,如果这些mRNA疫苗可以在较高的温度下存储和传递,他们表现出令人印象深刻的功效,“我可以想象它们将在全球范围内改变游戏规则,” Shivkumar补充说。里奇纳说,将来,辉瑞可能能够改善其疫苗在更高温度下更稳定。
有关的:最有希望的冠状病毒疫苗候选者
Shivkumar说,过去,与传统的疫苗相比,mRNA疫苗的反应没有足够强烈。她说:“因为使用mRNA,您使用如此低的水平并降解如此迅速,因此产生的蛋白质量的量将比给您蛋白质或减毒病毒的情况相对较低。”但是显然,科学家已经弄清楚了如何使mRNA稳定以引发强烈的保护反应。 Shivkumar补充说,虽然需要用每种病原体检查一下,但很明显,技术“绝对有所改善”。
俄亥俄州哥伦布市全国儿童医院的传染病主管Octavio Ramilo博士说:“拥有这些mRNA疫苗非常令人兴奋。”但是,“拥有不仅仅是一种策略将是一件好事,”因为您永远不知道哪一个会坚持下去。他补充说,并非所有平台都必须对每种病原体都起作用,尤其是因为每种病毒都可能具有隐藏免疫系统的独特策略。
拉米洛说,了解这些疫苗将如何在儿童和老年人中起作用,这也很重要。尽管许多试验包括老年参与者,但没有孩子。 Ramilo告诉Live Science,儿童对疫苗的反应与成年人的反应不同。
尤其是婴儿的免疫系统在第一年发生了巨大变化。” Ramilo说。拉米洛说,与其他年龄段相比,流感病毒倾向于对儿童和老年人的影响更严重。他说,但是疫苗在这些群体中的工作状况不佳。因此,拥有多个平台并了解它们的工作方式“将是利用并使它们在不同情况下工作的基础。”
杨说,如果从现在起多年以来,我们将有希望从2020年开始学习课程。大流行是mrna专家一直在等待的“概念证明”。在COVID-19大流行之前开发的最快疫苗是腮腺炎疫苗在1967年开发和许可花了四年。不计算开发疫苗所需的几年埃博拉病毒疫苗是临床试验中有史以来最快的测试,在整个西非的埃博拉病毒爆发期间,疫苗花了不到一年。也就是说,直到世界面临致命的大流行。
杨说,大流行仅九个月,新疫苗已经完成了临床试验“非常令人印象深刻”。 “当您谈论的是疫苗可能仅在FDA批准的几个月后才被FDA批准时,该疫苗最初是在一个非常快的人类中尝试的几个月后。”
“我不确定它实际上会比这快得多。”
最初发表在现场科学上。