科學家可能已經找到了一種自然調節血糖水平和對糖的渴望的方法,其方式與 Ozempic 等藥物類似。
在小鼠和人類中,發現解鎖這一自然過程的關鍵是腸道微生物及其代謝物——它在消化過程中產生的化合物。
中國江南大學的一個團隊領導的研究人員透過增加糖尿病小鼠體內這種腸道微生物的豐度,顯示它們可以「協調胰高血糖素樣勝肽-1 的分泌」。
胰高血糖素樣勝肽-1 (GLP-1) 是一種由人體自然產生的激素,有助於調節血糖水平和飽足感。 GLP-1 的釋放受到某些食物和腸道微生物的刺激,其作用機制類似於索馬魯肽(Ozempic 背後的成分)等藥物。
2 型人士通常 GLP-1 功能受損,導致血糖控制問題,這就是 Ozempic 和其他 GLP-1 激動劑作為治療藥物的原因。
這些藥物模仿體內的自然過程,雖然它們已被證明非常有效,但一些研究人員希望弄清楚如何讓身體自行產生更多的 GLP-1。
「越來越多的研究表明,我們對飲食成分的渴望源於腸道發出的信號,腸道是傳遞飲食偏好的關鍵器官,」解釋作者們。
“然而,目前尚不清楚腸道微環境中哪些基因、腸道菌群和代謝物參與糖偏好的調節。”
新研究顯示腸道微生物如普通擬桿菌它們的代謝物可能有助於塑造一個人對甜食的熱愛。
在實驗中,如果小鼠無法產生一種名為 Ffar4 的腸道蛋白,研究人員發現腸道菌落B、流行縮小了。這反過來又減少了一種名為 FGF21 的激素的釋放,這種激素與對糖的渴望有關。
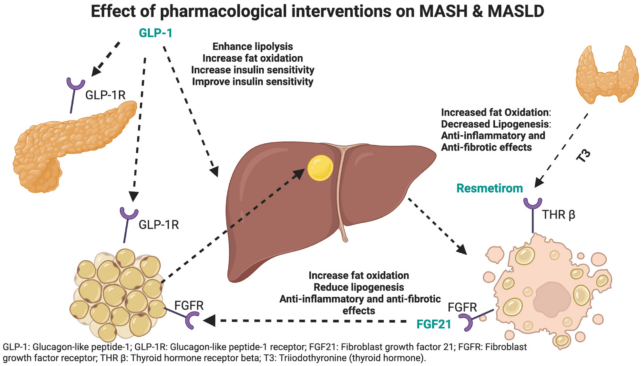
在服用 GLP-1 激動劑的小鼠的研究中,研究人員發現成立這些藥物會刺激 FGF21。
同時,在人類中,一些研究研究表明,具有 FGF21 激素基因變異的人成為甜食頂級消費者的可能性要高出約 20%。
中國的研究人員對60 名2 型糖尿病患者和24 名健康對照者進行了血液分析,發現Ffar4 突變會減少FGF21 的產生,與對糖的偏好增加有關,“這可能是導致糖尿病發展的重要因素” 。
更重要的是,腸道微生物組可能是這個過程的關鍵介質。
果然,研究團隊發現,當小鼠接受代謝物治療時B、粗俗,它促進了 GLP-1 的分泌,進而引發了 FGF21 的分泌。
總之,這意味著小鼠的血糖控制能力更強,對糖的渴望也更少。
同樣的情況是否會擴展到人類還有待觀察,但作者宣稱他們的研究「提供了預防糖尿病的策略」。
該研究發表於自然微生物學。