
CRISPR(CRISPR-CAS9)是一種基因組編輯工具,它允許科學家精確切割和修改DNA序列。它徹底改變了基因的研究,有助於增強作物並改善了醫療保健。
基因編輯系統最初是在細菌,通過剪輯病毒DNA限制感染。然後,在諾貝爾獎- 贏得工作,這種細菌防禦機構是由科學家選擇的,以設計一種新的基因組編輯方法。
“確實是簡單,成本和易用性”使這種編輯工具民主化,Alison van Eenennaam加利福尼亞大學戴維斯分校的牲畜遺傳學家告訴Live Science,他使用CRISPR改變了農場動物的遺傳學。
最近,CRISPR已被批准治療兩种血液疾病,並且早期試驗揭示了其治療遺傳失明的潛力。這是您需要了解的有關開創性技術的所有信息。
有關的:CRISPR“將為以前無法治癒的遺傳疾病提供治療方法。”
什麼是CRISPR?
CRISPR系統包括以下主要組成部分:
CRISPR:“ CRISPR”代表“定期間隔短的alindromic重複序列”。這個笨拙的名稱描述了在細菌基因組中發現的DNA序列的模式,可以幫助細菌抑制病毒。
“簡短的alindromic重複”指的是讀取相同前向和向後的序列,例如“皮划艇”和“賽車”。脫氧核糖核酸由兩條成對的鏈組成,在螺旋中互相扭曲。因此,DNA palindrome指的是一串DNA字母,或鹼基 - A(腺嘌呤),C(胞質),G鳥嘌呤)和T(胸腺素) - 當向前讀取一條鏈並向後讀書時,它們是相同的。
例如,如果一條鏈在一個方向上讀取“ GATC”,則這些DNA鹼基將與相對鏈上的“ CTAG”配對,因為G始終將與C與T始終與T配對。當向後讀取時,CTAG成為原始序列GATC。
這些重複是“定期間隔的”,這意味著基因組中的這些CRISPR區包含一種交替的palindromes模式,它們之間的“間隔者”序列在它們之間楔入。細菌選擇了從入侵病毒的DNA並將它們存放在其CRISPR地區,以抵抗未來的感染。
這個系統通常是比作人類適應性免疫系統,它類似地存儲了先前感染的“記憶”,以避免重複遇到。而不是使用免疫細胞,就像人類一樣,細菌使用CRISPR。
CRISPR RNA(CRRNA)和CAS9:CRISPR DNA是過去感染的永久記錄,但是要使細菌使用這些序列阻止病毒,它們必須將其轉化為DNA的表弟,RNA。通過稱為轉錄的過程,細菌首先將兩個CRISPR DNA鏈之一複製到一個互補的鏈rna;鍊是互補的,因為它與原始DNA代碼匹配,除非它用U(Uracil)代替T。然後,微生物將長鏈切成較短的crrna片段,每個片段都攜帶一個重複和一個墊片。
細菌還形成了第二個RNA分子,稱為“反式激活CRRNA,“或tracrrna。此RNA在CRRNA分子上包含重複的反向版本,從而使兩個RNA結合在一起。
然後,所得的複合物可以鎖定在帶有間隔序列的病毒DNA上,呼籲切割和禁用該DNA的酶。該酶,稱為“ CRISPR相關蛋白9”或Cas9,本質上是一對分子剪刀。
也有其他類型的CAS酶可以在基因編輯中使用。例如,一個叫CAS12A產生交錯的切口在DNA中,其中一條鏈比另一端更長。然後可以將DNA序列與懸垂鏈配對。CAS14在RNA中切割,而不是DNA,對於暫時改變細胞製造的蛋白質而不對其基因組進行永久編輯可能是有用的。
有關的:認識“扇形”,這是複雜生活中發現的第一個類似CRISPR的系統
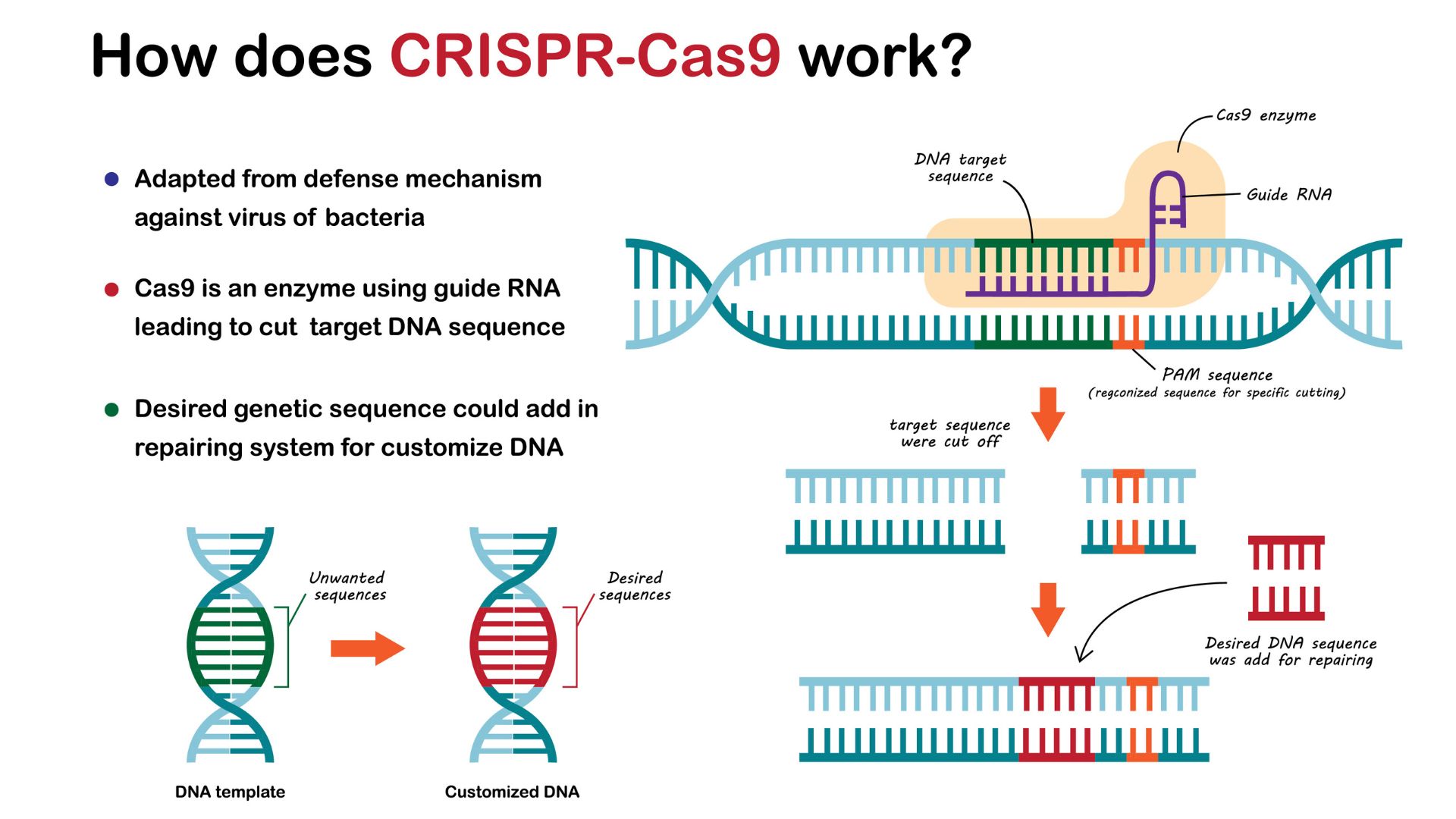
CRISPR如何編輯DNA?
研究人員利用了CRISPR系統在DNA中進行精確削減的能力。經過適應CRISPR來進行理想的基因組編輯在任何細胞類型中,研究人員都可以改變調節基因活性,改變其功能或表達的基因或DNA序列。
為了簡化系統,科學家將crrna和tracrrna分子結合在一起在上一節中描述為稱為“指導RNA”的單個分子。
範·埃涅納姆(Van Eenennaam)說:“要針對新序列,您需要做的就是改變指南。”相比之下,其他基因組編輯技術需要針對感興趣序列的實驗室製造蛋白的耗時且昂貴的設計。
引導RNA與CAS9酶配對以在基因組中進行編輯。一旦RNA結合了所需的序列,酶就會散入並切割兩個DNA的鏈。作為響應,該單元試圖將鏈粘合在一起,但它使用了故障的過程這通常會引入突變。例如,它可能會添加一些額外的字母。這種變化通常會停用基因,使CRISPR編輯成為關閉基因的簡單策略。
科學家還修改了CAS9酶以進行其他類型的編輯。通過禁用Cas9的遺傳剪刀,然後將此“死亡Cas9”融合到另一個酶,他們可以將機械裝置為改變單個基礎,例如,將C轉換為T。這種CRISPR的表述稱為“基礎編輯,“它使研究人員可以進行細微的變化,以改變由基因編碼的產物的結構,無論是蛋白質還是RNA。
Dead Cas9也已與酶配對啟用設定或者沉默基因調整其活性。死去的cas9也一直融合到熒光蛋白,當引導RNA結合到特定的DNA時,它會點亮,從本質上揭示其在細胞中的郵政編碼。
誰發現了CRISPR?
CRISPR的歷史可以追溯到1987年Ishino Yoshizumi日本大阪大學的同事首先報導了異常重複的序列在他們表現出寒意,一種眾所周知的細菌。當時,科學家不知道這些簇與細菌防禦有何關係。
在1990年代,這些集群引起了更多科學家的注意弗朗西斯科·莫吉卡(Francisco Mojica)(世界衛生組織創造了“ CRISPR”一詞)和他在西班牙阿利坎特大學的團隊發現了他們20其他細菌基因組,表明它們在細菌中廣泛重要。
2005年亞歷山大·博洛汀(Alexander Bolotin)法國國家農業研究所的同事遇到了CAS酶的基因位於基因組的CRISPR地區附近。不久之後,尤金·科旺(Eugene Koonon)的美國國立衛生研究院的小組揭示了間隔序列匹配的病毒DNA,導致研究人員將CRISPR與細菌免疫聯繫起來。
Emmanuelle Charpentier,德國的馬克斯·普朗克學院詹妮弗·杜德納(Jennifer Doudna)加利福尼亞大學伯克利分校,後來改編了CRISPR進行基因組編輯。他們的工作使他們分享2020諾貝爾化學獎。
在《夏爾潘蒂爾》和《杜德納的作品》的開創性出版後不久,弗吉尼亞斯·šikšnys維爾紐斯大學生物技術學院及其同事還展示了CRISPR如何用於基因編輯中。Feng Zhang'sBroad Institute的小組後來將其他CRISPR系統開發為基因編輯工具,包括RNA編輯系統涉及一種稱為CAS13的酶。

CRISPR是如何使用的?在動植物中呢?
CRISPR已用於糾正遺傳疾病,例如囊性纖維化和白內障,在實驗室生長的細胞和實驗室動物中。它還顯示了最近在人類試驗中對其他疾病的治療方法的成功。值得注意的是,英國和美國都有批准了一種基於CRISPR的基因療法,稱為Casgevy針對兩种血液疾病:鐮狀細胞病和β丘腦貧血。這是有史以來第一次基於CRISPR的療法。
Casgevy通過切割和禁用基因來起作用Bcl11a,可以控制出生後不久從胎兒血紅蛋白到成年血紅蛋白的轉變。
胎兒版本更強烈地與氧氣結合,允許胎兒從母親的血液中收集足夠的氧氣。成人版本通常在出生後接管,一旦可以通過呼吸獲得氧氣。然而,在鐮狀細胞疾病和β地中海貧血中,人們的成人基因有故障。 Casgevy逆轉轉向成年血紅蛋白的轉換,以便患者可以繼續使用其胎兒血紅蛋白基因。
一種繼承的失明形式可能是使用CRISPR治療的下一個疾病之一。試驗的早期試驗將CRISPR組件注入眼睛並建議採取安全有效模式的方法。 CRISPR的基礎編輯形式也顯示有希望的結果可以降低膽固醇水平在一次小型試驗中。
除了醫療保健之外,CRISPR編輯至少已用於增強41種食物作物,包括大米和小麥,通過改善其可口性,營養價值和對疾病的抵抗力。也已經習慣了編輯豬的基因然後將其器官用於人類移植操作。
此外,Van Eenennaam在概念驗證實驗中使用CRISPR來賦予養殖動物具有理想的特徵。例如,她增強肉產量在牛中,農民可以養成更少的牲畜,從而限制其環境影響。
CRISPR的潛在危險和缺點是什麼?
CRISPR是一種多功能且功能強大的基因組編輯工具,但是在這個關頭,它有一些局限性和風險,還提高了道德上的難題。
例如,關於治療遺傳疾病,有些人擁護自己的狀況和不要將它們視為疾病,範·埃涅納(Van Eenennaam)說。例如,“您應該在一對不相信耳聾是壞事的聾人後代中'治愈'遺傳性耳聾嗎?”她質疑。
關於CRISPR的局限性,如果CAS9酶在基因組的意想不到的位置切開DNA,它可能會引入“脫靶效應”。如果研究人員不為獨特的DNA靶標的指南RNA序列定制,而是針對基因家族中發現的常見序列,則可能發生這種情況。這種非目標效應可能會對健康產生負面影響。例如,如果引導RNA與抑制腫瘤生長的基因相匹配,則有可能使其變為細胞癌的風險。
另一個問題是CRISPR編輯是不是100%效率,因此只有一定比例的靶向細胞會經歷所需的遺傳變化。這意味著,在某些情況下,未經編輯的細胞可能會避免有害的脫靶效應,因此比編輯的細胞更好,最終超過了它們。研究人員最近發現 編輯的血液幹細胞可以加班死亡,提示血液疾病的治療可能在長期以來的效果下變得降低。
這些風險也對在牲畜中使用CRISPR的使用構成了道德上的考慮。 Van Eenennaam通常使用”種系編輯在牲畜中,涉及靶向性細胞,例如雞蛋和精子或受精卵。這使得CRISPR在動物和其後代之間可以遺傳。 VanEenennaam的群體並未將新工程的基因插入牛,而是將現有的,可取的基因轉移到另一頭牛中。
有關的:基因療法:它是什麼,它如何工作?
脫靶編輯有可能會損害動物的健康。但是范·埃涅納(Van Eenennaam)認為,這些擔憂常常被誇大。她解釋說:“兩隻公牛之間將有數百萬個遺傳變異。
儘管如此,美國食品藥品監督管理局(FDA)說養殖動物的基因組編輯需要充分的監督,部分原因是其他DNA序列通常伴隨著插入基因組的新基因。 FDA說,應審查這些結轉,以確保它們對動物或人類消費者沒有危害。如果該機構認為被編輯的動物是低風險的,他們可以授予”執法酌處權範·埃涅納(Van Eenennaam)指出:“這使其及其後代可以成為商業化。
這類種系編輯很少用於人類,除了在有爭議的情況下中國科學家臭名昭著地產生了“ CRISPR嬰兒”違反法規。避免人類種系編輯的一個重要原因是,子孫後代不能同意接受CRISPR治療。
子孫後代也不能同意有害的脫靶效應的可能性,例如可能使癌症患者容易產生的突變。尼塔牛群,杜克大學的生物倫理學家,告訴《紐約時報》編輯胚胎將是不道德的:“直到我們能弄清楚靶向效果是什麼,以及如何控制它們。”
美國國家科學,工程和醫學學院制定了標準,這些標準應符合生殖線編輯臨床試驗的前進。小組建議限制人類種系編輯對於那些突變的基因可以導致嚴重的疾病,沒有其他療法。
目前,基因療法主要使用一種稱為“軀體編輯。 ”
Van Eenennaam說:“好處顯然超過了任何假設的風險”,因此,在基因療法方面,體細胞CRISPR編輯是“不費吹灰之力的”。
編者註:本文的新版本於2024年7月1日發布。上一版本是在2023年3月進行的。
曾經想知道為什麼有些人比其他人更容易建立肌肉或者為什麼雀斑在陽光下出來?向我們發送有關人體如何工作的問題[email protected]有了主題行“ Health Desk Q”,您可能會在網站上看到回答的問題!









