自 COVID-19 疫苗取得成功以來,RNA 療法已成為生技界日益關注的對象。 這些療法與您的身體一起作用,針對疾病和感染的遺傳根源,這是傳統藥物的一種有前景的替代療法。
脂質奈米顆粒(LNP)已成功應用於幾十年來。 FDA 批准的療法使用它們作為傳遞信使RNA (mRNA) 和小幹擾RNA (siRNA) 的載體,信使RNA (mRNA) 促進細胞產生新蛋白質,小幹擾RNA (siRNA) 指示細胞沉默或抑制某些蛋白質的表達。
開發成功的 RNA 療法的最大挑戰是其標靶遞送。 目前的研究正面臨 LNP 目前的局限性,這導致許多疾病無法有效的 RNA 療法。
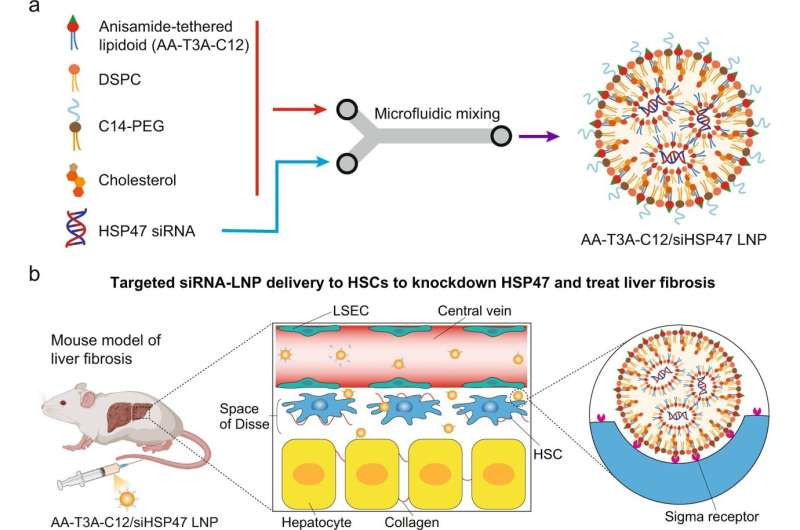
當肝臟反覆受損且癒合過程導致疤痕組織堆積,阻礙健康的肝功能時,就會發生肝纖維化。 它是一種慢性疾病,其特徵是富含膠原蛋白的細胞外基質 (ECM) 積聚過多。 由於缺乏針對活化的肝臟纖維母細胞的遞送系統,使用 RNA 療法治療肝纖維化仍然具有挑戰性。 固體成纖維細胞結構以及缺乏針對這些纖維母細胞的特異性或親和力都阻礙了目前的 LNP 進入活化的肝臟駐留成纖維細胞,因此它們無法提供 RNA 治療。
為了解決這個問題並幫助為數百萬患有這種慢性疾病的人提供治療,生物工程系創新助理教授 Michael Mitchell、J. Peter 和 Geri Skirkanich 以及博士後研究員雪翔韓和寧強發現,一種合成配體束縛的LNP 的新方法,提高其選擇性並允許它們靶向肝成纖維細胞。
Lulu Xu、Margaret Billingsley、Rakan El-Mayta、Sarah J. Shepherd、Mohamad-Gabriel Alameh 和 Drew Weissman(羅伯茨家族疫苗研究教授、佩雷爾曼醫學院 RNA 創新研究所所長)也對此做出了貢獻工作。
他們的研究發表於自然通訊,展示了小分子配體如何融入可電離脂質(LNP 的關鍵成分)的合成中,如何與肝臟中負責膠原蛋白積聚的難以靶向的活化成纖維細胞產生親和力。
膠原蛋白的堆積伴隨著熱休克蛋白 47 (HSP47) 表現的增加,這種蛋白驅動膠原蛋白的生物合成和分泌。 HSP47 的過度表現和膠原蛋白生物合成的增加最終會導致纖維化。
一旦它們的 LNP 到達並進入目標細胞,siRNA 就會被釋放,從而沉默 HSP47 的表達,抑制膠原蛋白的產生並阻止纖維化。 該療法在小鼠身上顯示出成功的效果,是治療人類肝纖維化的一種有前途的療法。
這種電離脂質合成的新方法是為 RNA 療法打開更多大門以治療多種疾病的關鍵。
「為了使LNP 具有足夠的選擇性來靶向驅動纖維化的肝星狀細胞,我們將茴香酰胺配體(一種對這些星狀細胞上的受體具有高親和力的分子)納入可電離脂質的結構中,」Mitchell 說。 “本質上,我們創建了一種鎖和鑰匙機制來瞄準和解鎖對這些難以到達的細胞的遞送。”
Han及其同事開發的合成工藝為「一鍋兩步驟」製程。 為了創建可電離脂質庫,團隊首先將茴香醯胺配體 (AA) 前體和不同的氨基核心放在一起。 然後他們添加疏水尾部以產生 AA 系鏈的可電離脂質。 由於其中性和穩定的性質以及對星狀細胞上過度表達的 σ 受體的親和力,選擇茴香醯胺作為配體。 在創建 AA 系鏈 LNP 庫後,研究小組透過兩輪選擇過程分析了它們靶向細胞並向細胞提供治療的能力。
「我們需要找到一種既有效又具有選擇性的特定 AA 系 LNP,」Han 說。 「第一輪選擇過程是透過檢查我們的 LNP 擊倒成纖維細胞中綠色螢光蛋白 (GFP) 的能力來測量效力。GFP 為治療性 RNA 如何即時關閉基因表現提供了很好的視覺證據。”
「在第二輪中,我們測試了強效 LNP 的選擇性能力,」Han 說。 「我們透過阻斷sigma 受體來了解特定AA 配體基團對LNP 進入目標細胞的能力有多重要。不出所料,我們表明AA 基團很重要;在sigma 受體阻斷後,我們失去了鎖定-and-key 機制和 AA 系留的 LNP 不會進入」。
研究團隊確定 AA-T3A-C12 是一種有效且選擇性的 LNP,攜帶治療性 siRNA,能夠實現小鼠 HSP47 表達 65% 的敲低,並增強受損肝組織的恢復。 研究結果得出結論,AA-T3A-C12 LNP 優於 MC3 LNP,MC3 LNP 是一種臨床使用的非病毒載體,已獲得 FDA 批准用於肝臟或肝臟細胞 RNA 治療。
這種新的配體束縛的 LNP 提供了一種治療方法該合成方法提供了一種將 LNP 定製到體內其他以前難以靶向的細胞和組織的方法。
「LNP 的潛力是巨大的,」Han 說。 “我們正在使 LNP 變得更聰明、更有效率。”
「我們很高興能夠開發出一種潛在的治療方法來解決這種肝病的遺傳根源,」米切爾說。 “而且,由於這種 LNP 遞送載體在肝臟纖維化細胞中發揮作用,因此可能會導致開發出針對體內其他類型纖維化的治療方法,例如肺部或腫瘤中出現的纖維化。”
“超出我們調查的範圍,這種創建 LNP 的方法可用於解鎖其他細胞類型的療法,」他補充道。「我們有可能透過將特定的標靶配體安裝到可電離的脂質結構中,在大腦、肺部或心臟中發揮作用。 這裡有很多途徑,我們很高興能夠繼續將這項研究推向新的方向。
引文:RNA 脂質奈米顆粒工程阻止肝纖維化,逆轉損害(2023 年,1 月17 日),2024 年6 月8 日檢索自https://webbedxp.com/science/jamaal/news/2023-01- rna-lipid-nanoarticle-liver -纖維化.html
本文件受版權保護。 除私人學習或研究目的的公平交易外,未經書面許可不得複製任何部分。 內容僅供參考。









