随着年龄的增长,患癌症的风险会逐渐减弱,我们终于知道为什么了
老龄化带来了两种相反的趋势风险:首先,风险攀升在我们 60 岁和 70 岁的时候,几十年的基因突变在我们的体内积累。但过了 80 岁左右,风险就会再次下降——一项新的研究可能会解释其中的一个关键原因。
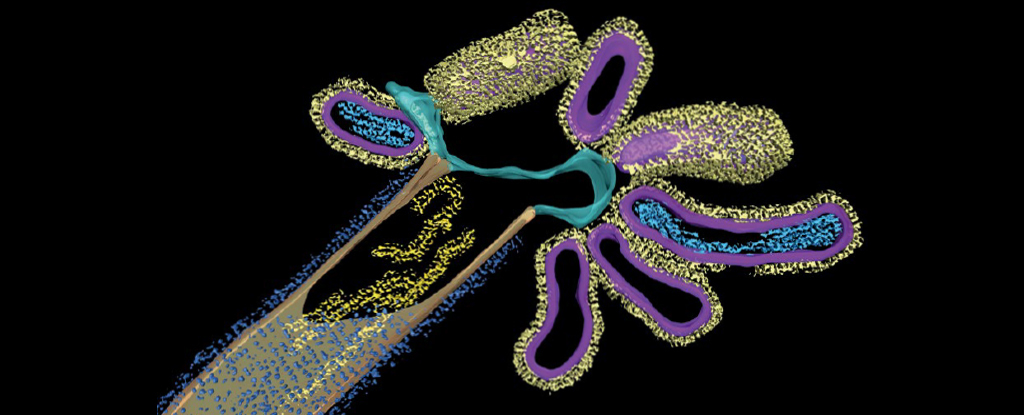
背后的国际科学家团队研究分析小鼠肺癌,追踪 2 型肺泡 (AT2) 的行为。这些细胞对于肺再生至关重要,也是许多细胞的来源。开始吧。
结果发现,老年小鼠体内一种名为 NUPR1 的蛋白质水平较高。这导致细胞表现得好像缺铁一样,进而限制了它们的再生率——对健康生长和癌性肿瘤都造成了限制。

“衰老细胞实际上含有更多的铁,但由于我们尚未完全了解的原因,它们的功能就像铁含量不足一样,”说来自纽约纪念斯隆凯特琳癌症中心 (MSK) 的癌症生物学家庄学谦。
“衰老的细胞失去了更新能力,因此也就失去了癌症中发生的失控生长的能力。”
人们发现人类细胞中也发生了相同的过程:更多的 NUPR1 会导致细胞可用的铁量下降。当人为降低NUPR1或人为增加铁时,细胞生长能力再次增强。
这可能为研究人员提供一种探索针对铁代谢的治疗方法,尤其是针对老年人。它也许可以恢复那些经历长期影响的人的肺活量, 例如。
这些发现也对基于一种称为“细胞死亡”的癌症治疗产生了影响。铁死亡,由铁触发。研究人员发现,这种细胞死亡在老年细胞中不太常见,因为它们的功能性缺铁。
这或许也使它们对正在开发的基于铁死亡的癌症治疗更具抵抗力——因此越早尝试铁死亡治疗,效果就越好。
“我们的数据表明,就癌症预防而言,我们年轻时发生的事件可能比以后发生的事件危险得多,”说来自 MSK 斯隆的癌症生物学家 Tuomas Tammela。
“因此,防止年轻人吸烟、晒黑或接触其他明显的致癌物质可能比我们想象的更重要。”
关于 NUPR1 的影响以及它与功能——健康再生和癌性生长——但这些都是在生命的任何阶段对抗癌症的重要发现。
与癌症治疗一样,需要考虑多种因素:癌症的类型和阶段、可能涉及的其他医疗状况以及(正如这项新研究所示)个人的年龄。更加个性化,它们就越有效。
“关于衰老实际上如何改变癌症的生物学,还有很多未知之处,”说壮。
该研究发表于自然。