一項新的研究首次揭示了受大腦的分子結構阿爾茨海默氏症疾病.
研究人員在大腦中產生了3D蛋白質模型,其中包括兩種與阿爾茨海默氏症相關的蛋白質:β-澱粉樣蛋白和獲得。
隨著科學家繼續致力於治療神經退行性疾病,重要的是要盡可能多地了解它。
大腦中這些蛋白質的團塊要么是阿爾茨海默氏症的原因,要么是它的結果 - 我們還不確定哪個 - 而且由於英國利茲大學的一支團隊,我們現在非常詳細地研究了它們的佈置,直到最微小的微觀細節。
“對人腦內部分子結構的第一次瞥見為阿爾茨海默氏病中蛋白質發生的一切提供了進一步的線索,”說利茲大學的神經科學家雷內·弗蘭克(RenéFrank)。
“但是[它]還提出了一種實驗方法,該方法可以應用於更好地理解其他毀滅性神經系統疾病。”
研究人員使用許多高級成像技術來掃描阿爾茨海默氏症患者的後腦組織,包括冷凍電子層析成像(冷凍) - 使用電子束的讀數來繪製在非常低溫下固定的組織的3D結構。
冷凍允許在沒有化學固定或脫水破壞生物組織結構的情況下進行成像,這意味著科學家現在可以重建分辨率的3D組織比一粒大米小一百萬倍。
“阿爾茨海默氏病大腦中澱粉樣蛋白的光顯微鏡表徵構成了診斷和疾病分類的基礎,”寫研究人員在發表的論文中。
“人腦中澱粉樣蛋白的原位結構尚不清楚。”

通過如此仔細地了解這些蛋白質,希望我們可以更好地了解團塊的形成方式以及它們如何影響大腦。
在β-澱粉樣蛋白中,發現了稱為原纖維和其他結構的微觀螺紋狀結構的混合物。在tau蛋白中,有直線的細絲簇,儘管該佈置似乎有所不同蛋白質在哪裡在大腦中。
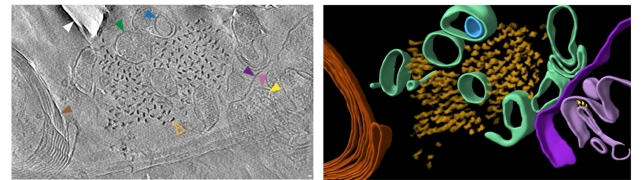
儘管群集彼此相似,但在空間組織之間存在差異,就tau細絲的定向和扭曲以及β-澱粉樣蛋白纖維的大小而言。
這是我們對這些細節級別上這些蛋白質的第一個外觀,現在說出有關揭示的意義的任何意義還為時過早。現在已經證明該技術可以使用,可以在更廣泛的腦供體範圍內對組織進行嘗試。
這將更多地揭示這些不同的蛋白質如何看待的不同點阿爾茨海默氏症的進步- 通過對跨時間的結構進行比較,我們應該能夠看到疾病的發展。

實際上,新研究背後的團隊認為,這種方法對於分析各種根本原因可能很有用神經退行性疾病,因此我們可以期望將來聽到更多有關它的信息。
“在不同的大腦區域以及阿爾茨海默氏病的早期階段,各種各樣的阿爾茨海默氏病供體的較大人群可能會揭示不同結構的澱粉樣蛋白的空間組織如何與個別神經病理學特徵有關,”寫研究人員。
“將這些方法應用於其他神經退行性疾病也很重要,其中許多神經退行性疾病具有相關或重疊的澱粉樣神經病理學類型。”
該研究已發表在自然。









